
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示. ![]()
A、C两种元素的原子核外电子数之和等于B原子的质子数,B2﹣的结构示意图为: ![]()
请回答下列问题:
(1)写出A、B、C三种元素的符号:A , B , C .
(2)B位于周期表中第周期族.
(3)C的氢化物的电子式为;A的最高价氧化物对应水化物的化学式为 .
(4)BC6作制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂.已知BC6在温度高于45度时为气态.BC6属于(填“离子”或“共价”)化合物.
【答案】
(1)N;S;F
(2)三;VIA
(3)![]() ;HNO3
;HNO3
(4)共价
【解析】解:A、B、C为短周期元素,根据这几种元素在周期表中的位置知,A和C位于第二周期、B位于第三周期,B2﹣的结构示意图为 ![]() ,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8﹣2=16,所以B是S元素;A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,(1)通过以上分析知,A为N,B为S,C为F,所以答案是:N;S;F;(2)B为S元素,S原子核外有3个电子层、最外层电子数是6,所以B位于周期表中第三周期VIA族,所以答案是:三;VIA;(3)C为F,C的氢化物的电子式为
,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8﹣2=16,所以B是S元素;A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,(1)通过以上分析知,A为N,B为S,C为F,所以答案是:N;S;F;(2)B为S元素,S原子核外有3个电子层、最外层电子数是6,所以B位于周期表中第三周期VIA族,所以答案是:三;VIA;(3)C为F,C的氢化物的电子式为 ![]() ,A的最高价氧化物对应水化物是硝酸,其化学式为HNO3 , 所以答案是:
,A的最高价氧化物对应水化物是硝酸,其化学式为HNO3 , 所以答案是: ![]() ;HNO3;(4)B为S,C为F,已知SF6在温度高于45度时为气态,SF6属于共价化合物, 所以答案是:共价.
;HNO3;(4)B为S,C为F,已知SF6在温度高于45度时为气态,SF6属于共价化合物, 所以答案是:共价.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,甲、乙均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
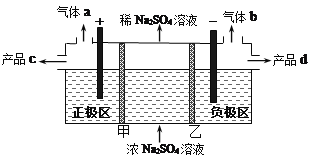
A. 甲为阳离子交换膜,通电后中间隔室的Na+离子向正极迁移
B. 通电后,同温同压下得到的气体a与气体b的体积比约为2:1
C. 通电后,得到的产品c是NaOH,产品d是H2SO4
D. 负极区发生的电极反应为2H2O +2e-=2OH-+H2↑,负极区溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是
A. 6.0gSiO2中含有0.1NA个SiO2分子
B. 标准状况下,向1L密闭容器中充入46gNO2气体,容器中的分子数为NA
C. 过氧化钠与水反应,每生成0.1mol氧气,转移电子的数目为0.4NA
D. 常温常压下,7.0g由丁烯与丙烯组成的混合物中含有氢原子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH-H要吸收的能量为436kJ,形成1molH-N放出391kJ的能量,氨气的结构如图,根据化学方程式N2+3H2 ![]() 2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
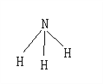
A. 431kJ B. 698kJ C. 946kJ D. 394kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取等物质的量的MgO和Fe2O3的混合物进行铝热反应,反应的化学方程式为________,引发铝热反应的实验操作是____。
(2)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。写出Be与NaOH溶液反应生成Na2 [Be(OH) 4]的离子方程式__________________。
(3)5.4g某元素R的单质与足量的盐酸反应,生成RCl3和6.72L氢气,R的质子数比中子数少1个,则R的原子符号为______________,R的氧化物溶于强碱的离子方程式______________。
(4)实验室不能用带玻璃塞试剂瓶装NaOH溶液,用化学方程式和简要文字说明_____________。
(5)作为麻醉剂,氙气在医疗上很受重视,它的原子序数是____。取1mol氙气和3.5mol氟气于一密闭容器内充分反应,后来余下了1.5mol的氟气同时有白色固体生成 ,此白色固体的化学式为_________。
(6)若要使1mol CH4完全和Cl2发生取代反应,并生成相同物质的量的四种取代产物,则生成HCl的物质的量为________。
A.5 mol B.4mol
C.2.5mol D.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%. 
(1)A的化学式为; F的化学式为;
(2)反应③的化学方程式:;
(3)反应②的离子方程式:;
(4)反应④的离子方程式:;
(5)已知每生成16g E,放出106.5kJ热量,则反应①的热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项正确的是
A. 25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B. NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
C. 25℃时,将0.01mol/L的醋酸溶液加水不断稀释,  减小
减小
D. Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有着广泛的应用。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体,同时得到浅绿色酸性溶液。为此,他们设计了如下装置验证所产生的气体(夹持装置省略)并进行有关实验。

(1)①若装置A中的试管不加热,则没有明显现象,原因是____________。
②证明有SO2 生成的现象是_____;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4,请写出装置B处反应的化学方程式________________。
(2)取装置A试管中的溶液6mL,加入适量氯水恰好反应,再加入过量的KI溶液后,分别取2mL此溶液于3支小试管中进行如下实验:
①第一支试管中加入1mLCCl4,充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有____(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为_______。
(3)向盛有H202溶液的试管中加入几滴装置A试管中的溶液,溶液变成棕黄色,发生反应的离子方程式为_________________;一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。产生气泡的原因是________________;生成沉淀的原因是_______________ (用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是:
A. 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B. 100 mL 2 molL﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. 反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com