
短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族。则下列叙述正确的是
A.原子半径:A<B<C
B.氢化物稳定性:A<C
C.B与A的化合物比B与C的化合物熔点低
D.A与C的化合物属于大气污染物
D
解析试题分析:A原子的次外层电子数等于B原子的最外层电子数,由于最外层电子数不能超过8个,因此A的次外层电子数是2个,则B的最外层电子数是2个。又因为A与C同主族,且三者原子最外层电子数之和为14,则A和C的最外层电子数=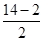 =6。由于短周期元素A、B、C的原子序数依次递增,因此A是氧元素,B是镁元素,C是硫元素。A、同周期自左向右原子半径逐渐减小。同主族自上而下原子半径逐渐增大,则原子半径:A<C<B,A不正确;B、非金属性越强,氢化物的稳定性越强。同主族自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则氢化物稳定性:A>C,B不正确;C、B与A的化合物是氧化镁属于离子化合物,B与C的化合物硫化镁,也是离子化合物。因此二者形成的晶体均是离子晶体。由于氧离子半径小于硫离子半径,所以氧化镁的熔点高于硫化镁的熔点,C不正确;D、SO2属于大气污染物,D正确,答案选D。
=6。由于短周期元素A、B、C的原子序数依次递增,因此A是氧元素,B是镁元素,C是硫元素。A、同周期自左向右原子半径逐渐减小。同主族自上而下原子半径逐渐增大,则原子半径:A<C<B,A不正确;B、非金属性越强,氢化物的稳定性越强。同主族自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则氢化物稳定性:A>C,B不正确;C、B与A的化合物是氧化镁属于离子化合物,B与C的化合物硫化镁,也是离子化合物。因此二者形成的晶体均是离子晶体。由于氧离子半径小于硫离子半径,所以氧化镁的熔点高于硫化镁的熔点,C不正确;D、SO2属于大气污染物,D正确,答案选D。
考点:考查元素周期表的结构和元素周期律的应用


科目:高中化学 来源: 题型:单选题
某同学设计如下元素周期表,以下说法正确的是
| A.X、Y、Z元素分别为N、P、O |
| B.白格中都是主族元素,灰格中都是副族元素 |
| C.原子半径:Z>X>Y |
| D.X、Y、Z的气态氢化物中最稳定的是:Z的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是
| A.J和氢组成的化合物分子中只含有极性共价键 |
| B.工业上用电解熔融的M的氧化物方法来制备M |
| C.R、T两元素的气态氢化物中,T的气态氢化物更稳定 |
| D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于C、Si、S、Cl四种元素的说法中,正确的是
A.在自然界中都能以游离态存在
B.两两结合形成的化合物都是共价化合物
C.氢化物的热稳定性比较:CH4>SO42->IO3->I2
D.反应①、②中生成等量的I2时转移电子数比为1:5
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是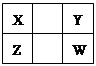
| A.Z元素的原子半径可能比Y元素的小 |
| B.Z的原子序数不可能是X的原子序数的2倍 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的最高价氧化物的水化物的酸性一定比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
R为短周期元素,其原子所具有的电子层数为最外层电子数的一半。下列说法中不正确的是
| A.当它形成含氧酸根离子R2O42—时,也可以形成RO32— |
| B.当它形成含氧酸根离子RO42—时,还可以形成HRO3— |
| C.当它形成含氧酸根离子RO4—时,还可以形成RO3— |
| D.当它形成含氧酸根离子R2O72—时,也可以形成RO42— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有四种元素的基态原子的电子排布式如下 ①1s22s22p63s23p4 ②1s22s22p63s23p3; ③1s22s22p5下列正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.不成对电子数:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合史实的是
①道尔顿提出的原子论 ②卢瑟福的原子结构行星模型
③波尔提出的原子力学模型 ④汤姆生提出的葡萄干面包原子模型
| A.①④②③ | B.①②④③ | C.②①④③ | D.①③②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com