
【题目】为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
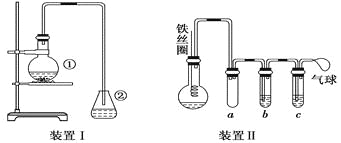
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置I中①的化学方程式为__________________________________________.
②中离子方程式为__________________________________________________.
(2)①中长导管的作用是________________________________________________.
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用__________________________试剂洗涤.洗涤后分离粗产品应使用的仪器是____________________.
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.
a的作用是__________________________________________________________.
b中的试剂是__________________________________________________________.
比较两套装置,装置Ⅱ的主要优点是______________________________________
________________________________________________________________________.
【答案】2Fe+3Br2===2FeBr3,![]() Br-+Ag+===AgBr↓ 导气兼冷凝回流
Br-+Ag+===AgBr↓ 导气兼冷凝回流 ![]() 与Br2 NaOH溶液或水 分液漏斗 防止倒吸 CCl4或
与Br2 NaOH溶液或水 分液漏斗 防止倒吸 CCl4或![]() 可以控制反应进行 避免杂质干扰;防止污染空气
可以控制反应进行 避免杂质干扰;防止污染空气
【解析】
(1)因溴与铁反应生成溴化铁:2Fe+3Br2 ═2FeBr3,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢:![]() ;②中反应的离子方程式为Br-+Ag+═AgBr↓,故答案为:2Fe+3Br2═2FeBr3,
;②中反应的离子方程式为Br-+Ag+═AgBr↓,故答案为:2Fe+3Br2═2FeBr3,![]() ;Br-+Ag+═AgBr↓;
;Br-+Ag+═AgBr↓;
(2)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气,冷凝回流,故答案为:导气兼冷凝回流;
(3)反应生成的溴苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液,故答案为:![]() 与Br2;NaOH溶液(或水);分液漏斗;
与Br2;NaOH溶液(或水);分液漏斗;
(4)从图上信息可知,支管是短进短出a的作用是防止倒吸安全装置;B中要除去Br2,试剂为苯或四氯化碳,该装置的优点是:可以控制反应进行;避免杂质干扰;防止污染空气,故答案为:防止倒吸;CCl4或![]() ;可以控制反应进行;避免杂质干扰;防止污染空气。
;可以控制反应进行;避免杂质干扰;防止污染空气。


科目:高中化学 来源: 题型:
【题目】“空气吹出法”海水提溴的工艺流程如图:
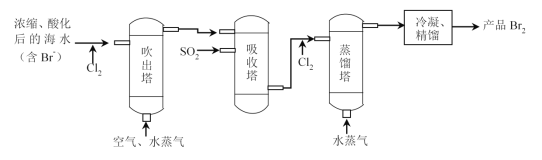
下列说法不正确的是( )
A.进入吹出塔前,Br-被氧化为Br2
B.从吸收塔流出的溶液主要含HBr和H2SO4
C.经过吸收塔后,溴元素得到富集
D.两次通入水蒸气的作用都是参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述不正确的是( )
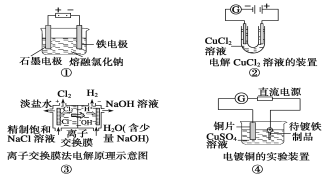
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等
B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小
C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过
D.装置④的待镀铁制品应与电源负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸盐(ClO4-)有高稳定性和强氧化性,常作为氧化剂用于工业生产。
(1)高氯酸盐中氯元素的化合价为________。
(2)下列叙述中可说明氯元素比硫元素非金属性强的是_________。
① HCl比H2S稳定
② HClO4的酸性比H2SO3的强
③ Cl2可与Na2S发生置换反应
(3)NH4ClO4是复合火箭推进剂的重要成分,实验室可通过反应NaClO4+NH4Cl![]() NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
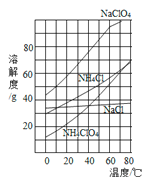
① 结合溶解度,分析该反应能够发生的原因________。
② 从反应后热的混合液中获得较多NH4ClO4晶体的实验操作依次为________、蒸发浓缩、冷却结晶、过滤、冰水洗涤。
(4)高氯酸盐是一种新型的无机污染物,ClO4-的主要危害是与碘离子竞争进入人体甲状腺,影响甲状腺的正常功能。利用电化学催化法,酸性环境中,可将ClO4-还原为Cl-,该电极反应式为________。
(5)已知,加热时Cu(ClO4)2的分解方式有以下两种:
2Cu(ClO4)2 ![]() 2CuO+7O2↑+2Cl2↑
2CuO+7O2↑+2Cl2↑
Cu(ClO4)2 ![]() CuCl2+4O2↑
CuCl2+4O2↑
取一定质量的Cu(ClO4)2·6H2O样品,加热至某温度使其完全分解,若测得V(O2)∶V(Cl2)=5∶1,则分解所得固体产物中CuO与CuCl2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.往澄清的石灰水中通入过量CO2:Ca2++ 2OH-+ CO2=CaCO3↓+ H2O
B.用小苏打(NaHCO3)治疗胃酸过多:HCO3-+ H+= H2O+ CO2↑
C.往碳酸钡中滴加稀盐酸:CO32-+2 H+= H2O + CO2↑
D.氢氧化钡溶液与稀H2SO4反应:Ba2++ SO42-+ H++ OH-= H2O+ BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒。这是因为对人体无害的![]() 价砷类化合物在维生素C的作用下,能够转化为有毒的
价砷类化合物在维生素C的作用下,能够转化为有毒的![]() 价的含砷化合物。通过以上信息填空:
价的含砷化合物。通过以上信息填空:
①维生素C具有______(填“氧化性”或“还原性”)。
②3mol +5价砷完全转化为![]() 价砷,共转移______个电子。
价砷,共转移______个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铁加热易升华,遇潮湿空气易变质。在实验室中,可以采用如下装置和药品制取较纯的无水氯化铁固体。
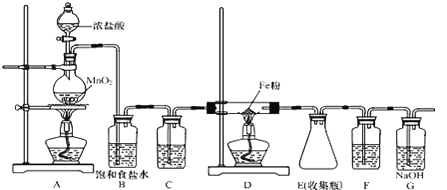
(1)制取氯化铁时,应先点燃_____(填“A”或“D”)处的酒精灯,制取氯化铁的化学方程式为_____。
(2)C、F装置中所装试剂相同,试剂均为________。
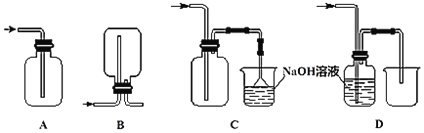
(3)下列收集Cl2的正确装置是______。
(4)G装置中反应的离子方程式为________________________________。
(5)反应后装置D中残余的固体混合物溶于稀盐酸,滴加几滴KSCN溶液。若溶液变血红色,推断固体物质的成分为______(选填序号,下同);写出溶液变血红色的离子方程式:_____________,若溶液未变血红色,推断固体物质的成分为______。
A.只有 FeCl3 B.只有Fe C.一定有FeCl3 D.一定有Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,实验小组同学进行如图实验,下列说法错误的是
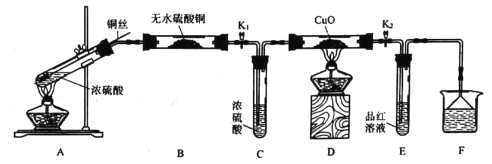
A.F中可以盛放酸性KMnO4溶液
B.为确认有硫酸铜生成,可向反应后的A中加水
C.此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断
D.可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下:
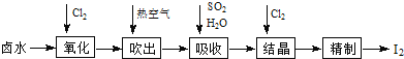
以下说法正确的是( )
A.“氧化”时,须通入过量Cl2保证I-被充分氧化
B.“吹出”操作在吹出塔中进行,应将含碘卤水从塔底进入,热空气从塔顶吹入
C.“吸收”操作中,碘蒸气与二氧化硫水溶液充分接触可生成两种酸
D.“吸收”操作中,含SO2的吸收液也可以用NaOH溶液代替,生成的I-、IO3-经酸化,即可得粗碘。使用NaOH吸收后溶液中I-、IO3-的物质的量之比为1∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com