
【题目】为研究铜与浓硫酸的反应,实验小组同学进行如图实验,下列说法错误的是
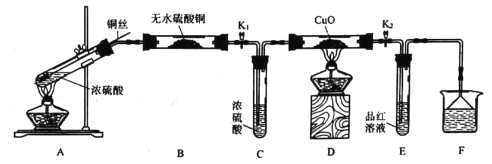
A.F中可以盛放酸性KMnO4溶液
B.为确认有硫酸铜生成,可向反应后的A中加水
C.此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断
D.可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素
【答案】B
【解析】
此探究实验的实验目的为研究铜与浓硫酸的反应,A中发生的反应为![]() ,B的作用是为了验证水蒸气的生成,C中浓硫酸的作用是除掉混合气体中的水,防止后续热还原操作出现危险,D装置是为了探究是否有
,B的作用是为了验证水蒸气的生成,C中浓硫酸的作用是除掉混合气体中的水,防止后续热还原操作出现危险,D装置是为了探究是否有![]() 等还原性气体的生成,E中品红褪色,说明产物中有
等还原性气体的生成,E中品红褪色,说明产物中有![]() ,F装置为尾气处理装置。
,F装置为尾气处理装置。
A. 根据上述分析,F为尾气处理装置,可以使用具有强氧化性的KMnO4溶液来吸收尾气![]() ,A正确;
,A正确;
B. 由于反应结束后A装置中还残留有浓![]() ,故应当取少量A中的溶液,加入水中,进而观察现象,B错误;
,故应当取少量A中的溶液,加入水中,进而观察现象,B错误;
C. A装置中水的来源可能有两部分,一是反应生成的,二是浓![]() 中本来就有的,故此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断,C正确;
中本来就有的,故此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断,C正确;
D. 可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素,D正确;
故答案选B。


科目:高中化学 来源: 题型:
【题目】我国是煤炭消费大国,高硫煤(主要含FeS2)在我国煤炭消费中占有相当大的比例,其燃烧时产生的SO2对环境和人体健康造成了一定的负面影响,所以运用电化学法进行煤的燃前脱硫是一项具有前景的技术。已知:2FeS2+7O2+8NaOH=2Fe(OH)2+4Na2SO4+2H2O,图甲是模拟电化学法脱硫的示意图(电极均为惰性电极),对此方法说法不正确的是
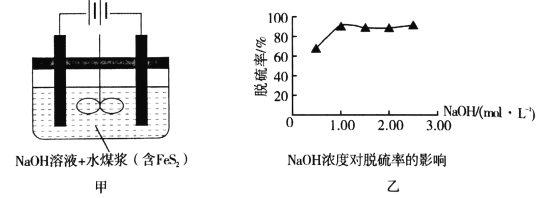
A.将煤制成水煤浆加入电解槽有利于反应的充分进行
B.阳极的电极反应式为4OH--4e-=O2↑+2H2O
C.煤中的铁元素最终以Fe(OH)2的形式存在
D.根据图乙中的信息,NaOH溶液的适宜浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
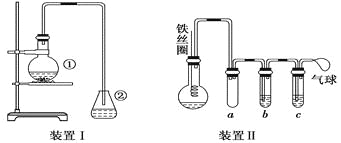
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置I中①的化学方程式为__________________________________________.
②中离子方程式为__________________________________________________.
(2)①中长导管的作用是________________________________________________.
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用__________________________试剂洗涤.洗涤后分离粗产品应使用的仪器是____________________.
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.
a的作用是__________________________________________________________.
b中的试剂是__________________________________________________________.
比较两套装置,装置Ⅱ的主要优点是______________________________________
________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体 ,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色。
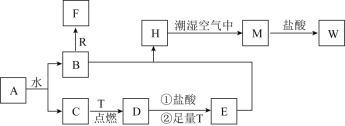
(1)物质D的化学式为___________,H的名称___________。
(2)![]() 在潮湿空气中变成M的实验现象是______________,化学方程式为___________。
在潮湿空气中变成M的实验现象是______________,化学方程式为___________。
(3)![]() 与W溶液也能发生反应,其反应的类型为______(填序号)。
与W溶液也能发生反应,其反应的类型为______(填序号)。
![]() 化合反应
化合反应 ![]() 置换反应
置换反应 ![]() 复分解反应
复分解反应 ![]() 氧化还原反应
氧化还原反应
(4)![]() 和R在溶液中反应生成F的离子方程式为____________________。
和R在溶液中反应生成F的离子方程式为____________________。
(5)将![]() 投入到E溶液中,可以观察到的现象是:___________________。
投入到E溶液中,可以观察到的现象是:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为短周期元素,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)
① | ② | |||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(1)上述元素中金属性最强和非金属性最强的元素名称分别是______,_______;
(2)①和②的气态氢化物稳定性比较(写化学式):______________;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为_________;写出⑤单质与③的最高价氧化物对应水化物反应的化学方程式为____________ 。描述H2在⑧单质中燃烧的现象___________________;
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是_________________;
(5)比较②和③对应简单离子的离子半径大小(用相应离子符号表示)________;
(6)写出③的最高价氧化物对应水化物的电子式___________;其含有的化学键类型是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:

回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时反应温度不宜过高,其原因为________(用化学方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 。将一定量的硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示。下列说法错误的是
。将一定量的硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示。下列说法错误的是
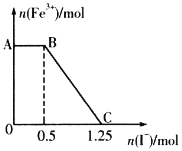
A.AB段发生I-被![]() 氧化的反应
氧化的反应
B.BC段发生的反应为![]()
C.开始时加入KMnO4的物质的量为0.15mol
D.开始时加入FeSO4的物质的量为1.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g) ![]() 2NO2(g)△H=-110kJ·mol-1
2NO2(g)△H=-110kJ·mol-1
25℃时,将NO和O2按物质的量之比为2:1充入恒容反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 |
|
p/kPa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;随着反应进行,反应速率逐渐减小的原因是______________。
用平衡分压代替平衡浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为_______(保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g) ![]() 2NO2(g)有如下两步历程
2NO2(g)有如下两步历程
第一步2NO(g) ![]() N2O2(g) 快速反应
N2O2(g) 快速反应
第二步N2O2(g)+O2(g) ![]() 2NO2(g) 慢反应
2NO2(g) 慢反应
总反应速率主要由第_____步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将___(填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强P(35℃)______P(25℃)(填“大于”、“等于”或“小于”)。
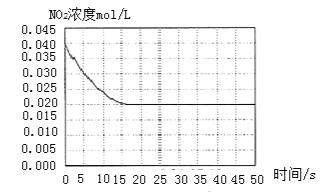
II. 某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。
(1)反应体系达平衡后压强为P1,若升高温度,再次达平衡后,混合气体的平均相对分子质量______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;
(2)若在恒温恒容条件下,向平衡体系中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol/L,则P2:P1=______
(3)该温度下反应2NO(g)+O2(g) ![]() 2NO2(g)的化学平衡常数K为______。
2NO2(g)的化学平衡常数K为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于非氧化还原反应的是( )
A. Fe2O3+3CO![]() 2Fe+3CO2 B. NH4NO3
2Fe+3CO2 B. NH4NO3![]() N2O↑+2H2O
N2O↑+2H2O
C. 2NaHCO3![]() Na2CO3+CO2↑+H2O D. CuO+CO═Cu+CO2
Na2CO3+CO2↑+H2O D. CuO+CO═Cu+CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com