
(4分)稀盐酸与铝发生反应,要生成3.36L氢气(标准状况),需消耗铝 g;反应过程中转移 mol电子。
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应较快,产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
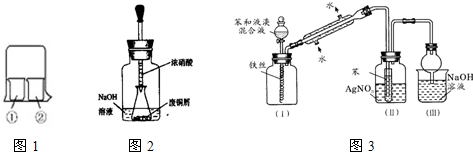
| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖南岳阳等四县一中高二第六次质检化学试卷(带解析) 题型:填空题
(4分)稀盐酸与铝发生反应,要生成3.36L氢气(标准状况),需消耗铝 g;反应过程中转移 mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com