
| A. |  2-甲基-3-丁烯 | B. |  乙 基苯 | C. |  2-乙基 丙烷 | D. |  1-甲基乙醇 |
分析 A、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子编号;
B、此有机物是乙基取代了苯环上的一个H原子;
C、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上的碳原子编号;
D、醇命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子编号.
解答 解:A、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有4个碳原子,从离官能团近的一端给主链上的碳原子编号,故在3号碳原子上有一个甲基,故名称为3-甲基-1-丁烯,故A错误;
B、此有机物是乙基取代了苯环上的一个H原子,故名称为乙基苯,简称乙苯,故B正确;
C、烷烃命名时,要选最长的碳链为主链,故主链上有4个碳原子,从离支链近的一端给主链上的碳原子编号,故在2号碳原子上有一个甲基,故名称为2-甲基丁烷,故C错误;
D、醇命名时,要选含官能团的最长的碳链为主链,故主链上有3个碳原子,从离官能团近的一端给主链上的碳原子编号,故名称为2-丙醇,故D错误;
故选B.
点评 本题考查了有机物的命名,应注意的是含官能团的物质在命名时,在选主链和编号位时考虑的对象为官能团,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
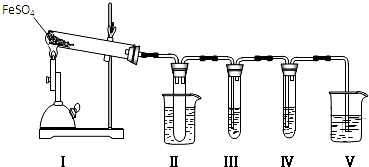
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5mol.L-1BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水). |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图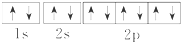 | |
| B. | Na+的结构示意图: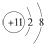 | |
| C. | 基态Na原子的电子排布式:1s22s22p53s2 | |
| D. | 基态Na原子的价电子排布式:3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH${\;}_{4}^{+}$=Mg2++2NH3•H2O | |
| B. | 磷酸一氢钠溶液水解:HPO${\;}_{4}^{2-}$+H2O?PO${\;}_{4}^{3-}$+H3O+ | |
| C. | 电解AlCl3溶液:2Al${\;}_{3}^{+}$+6Cl-+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑+3Cl2↑ | |
| D. | 铜片接电正极,碳棒接电负极,电解硫酸溶液:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com