
【题目】固体化合物X由3种元素组成。为确定其组成,某学习小组进行了如下实验,相关表述不正确的是( )
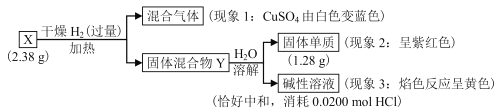
A.由现象1可以确定化合物X中含有氧元素
B.固体混合物Y的成分为Cu和NaOH
C.可以确定X的化学式为Na2Cu2O3
D.根据X的组成和相关元素的化合价预测其具有氧化性
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.NaH与H2O反应生成氢气,每生成0.6g氢气转移电子数为0.6NA
B.12g镁在空气中充分燃烧,电子转移数目为NA
C.0.1 mol熔融NaHSO4中含有阳离子数目为0.1NA
D.标准状况下,6.72 L O2和N2的混合气体含有的原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A,请填空。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为_____ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到________(填现象) |
(2)综合上述实验现象和结论___(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_____________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点______(填“正确”或“错误”),原因是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ge、Na及其化合物在航空航天、电子工业上有重要应用。请回答下列问题:
(1)基态Ge原子价层电子的排布式为___,其电子填充的最高能级的轨道数为___。电子占据最高能级的电子云轮廓图为___形。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是___。
(3)硼氢化钠(NaBH4)是有机化学中的一种常用还原剂,[BH4]-的空间构型是__,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)NaC1是离子晶体,其晶格能可通过下图的循环计算得到。
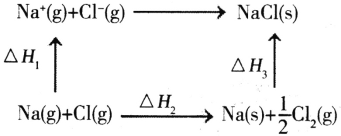
△H(晶格能)=___。
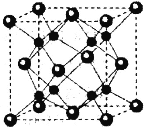
(5)Na2O的立方晶胞如图所示,氧离子采取面心立方堆积,钠离子填在由氧离子形成的__空隙中。已知晶胞边长a=0.566nm,晶胞中O原子的配位数为__;该晶体的密度是___g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12∶3∶8。液态烃B是一种重要的化工原料,其摩尔质量为78g·mol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):

请回答:
(1)化合物A的结构简式是____________。
(2)A与D反应生成E的反应类型是____________。
(3)E与氢氧化钠溶液发生水解化学方程式是________________________。
(4)下列说法正确的是____________。
A.将铜丝在空气中灼烧后迅速插入A中,反复多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为![]()
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol 的B和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料,工业上由N2和H2在一定条件下合成。
(1)已知H2的标准燃烧热为△H1=-akJ·mol-1,NH3的标准燃烧热为△H2=-bkJ·mol-1。则合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的△H3=_________ kJ·mol-1 (用含a、b的代数式表示)。
2NH3(g)的△H3=_________ kJ·mol-1 (用含a、b的代数式表示)。
(2)合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g)在一定温度下能自发进行,则△H3______0(填“>”或“<”),原因是__________。
2NH3(g)在一定温度下能自发进行,则△H3______0(填“>”或“<”),原因是__________。
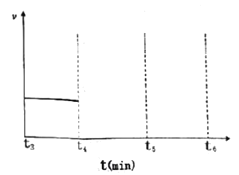
(3)一定温度下,向体积为2L的密闭容器中通入一定量的N2和H2反生反应,有关物质的量随反应时间的变化如图所示。该温度下,反应的平衡常数为_________________。
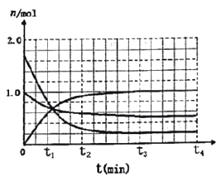
若在t4时刻,同时向体系中再通入0.5 mol N2和1moNH3,t5时刻重新达到平衡,请在下图中画出t4~t6时间段逆反应速率随时间的变化图_____________。
(4)文献报道,常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质可在电极上直接生成氨气。阴极的反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
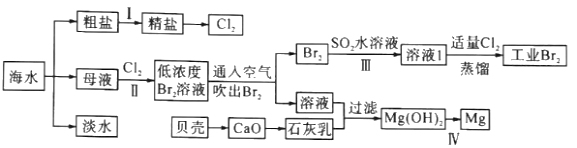
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:__。
(2)海水提溴,制得1molBr2需要消耗__molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为___。
(3)判断Mg(OH)2是否洗涤干净的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol·L的氨水滴定l0.00mL0.05mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg![]() 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
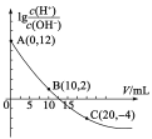
A.A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为1.0×10-6mol·L-1
D.C点溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com