
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃时,pH=1的盐酸溶液中,由水电离出的H+个数为10-13NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
C. 1L0.1molL-1NaHCO3溶液中含有0.1NA个HCO3-
D. 100gCaCO3与KHCO3的混合物中含有的阴离子的数目为NA
【答案】D
【解析】
A、水的电离方程式为:H2O![]() H++OH-,25℃时kw=c(H+)×c(OH-)═1×10-14,pH=1的盐酸,c(H+)=0.1mol/L,由水电离生成的c(H+)=c(OH-)=
H++OH-,25℃时kw=c(H+)×c(OH-)═1×10-14,pH=1的盐酸,c(H+)=0.1mol/L,由水电离生成的c(H+)=c(OH-)=![]() mol/L=10-13mol/L,但由于溶液体积未知,故不能计算由水电离出的H+个数,故A错误;
mol/L=10-13mol/L,但由于溶液体积未知,故不能计算由水电离出的H+个数,故A错误;
B、根据化学方程式中元素化合价变化和氧化还原反应规律同元素不同价态发生氧化还原反应,元素化合价只能靠近不能交叉,在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA,故B错误;
C、1L0.1mol/L的NaHCO3溶液中含有0.1mol溶质碳酸氢钠,由于碳酸氢根离子部分水解,则HCO3-离子数小于0.1NA,故C错误;
D、100 g CaCO3与KHCO3的混合物的物质的量为1mol,含有1mol阴离子,含有的阴离子的数目为NA,故D正确。
答案选D。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】在下图银锌原电池中,以硫酸铜为电解质溶液。

(1)锌为______极,该电极上发生的是_____________反应(“氧化”或“还原”),电极反应式为__________________________________。
(2)银为____极,电极上发生的是_______反应(“氧化”或“还原”),电极反应式是__________________,银片上观察到的现象是__________________________。
(3)该原电池的总反应式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
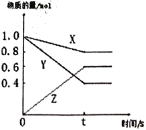
(1)写出该反应的化学反应方程式____________________________________。
(2)该温度下此反应的平衡常数______________________。
(Ⅱ).已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0请回答下列问题:
P(g)+Q(g) ΔH>0请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为___________;
(4)若反应温度升高,M的转化率_______(填“增大”“减小”或“不变”) ;
(5)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_________;
(6)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,浓硫酸不与铜反应,是因为铜被钝化
B.可用铁罐来进行储存、运输冷的浓硫酸
C.SO3具有氧化性,SO2只有还原性
D.SO2、Cl2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
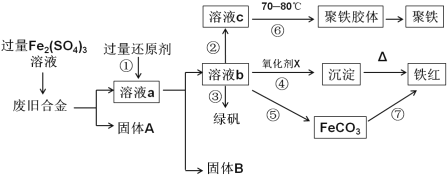
(1)①中过量的还原剂应是____________________。
(2) 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_______________________。
(3)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70-80℃的目的是________。
(4)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_________________________。
(5)在④中的氧化剂X是________________________。
(6)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出离子反应方程式 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A.氨遇硫酸冒白烟
B.氨在一定条件下能与氧气反应生成一氧化氮和水
C.氨是一种极易溶于水,且易液化的气体
D.氨能使酚酞试液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定试样Fe2O3、Cu、Fe混合物中铜的质量分数,某同学取质量为ag的试样进行下列实验,所得气体数据在标准状况下测得,所涉及的过程如下:

注:已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Cu2+ |
开始沉淀PH | 2.5 | 7.0 | 4.7 |
完全沉淀PH | 3.7 | 9.0 | 6.7 |
下列说法不正确的是
A. 气体B为氢气
B. 溶液A中所含的阳离子可能是H+ 、 Fe3+ 、 Fe2+、 Cu2+
C. 加入过氧化氢溶液时发生的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 若沉淀E经洗涤、烘干、灼烧后得到固体mg,则试样中Cu的质量分数=(a-0.56)/a×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
Ⅰ.已知反应:①CH4(g)+H2O (g) ![]() CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②C(s)+H2O (g) ![]() CO(g)+ H2(g) ΔH=+131 kJ·mol-1
CO(g)+ H2(g) ΔH=+131 kJ·mol-1
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。CH4(g) ![]() C(s)+2H2(g) ΔH=________kJ·mol-1。
C(s)+2H2(g) ΔH=________kJ·mol-1。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是_______(填序号)
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
Ⅱ.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:
(1)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
A.v(H2)正=v(CH3OH)逆 B.2v(CO)=v(H2)
C.CO与H2转化率相等 D.CO与H2的物质的量之比不再改变
(2)图是该反应在不同温度下CO的转化率随时间变化的曲线。温度T1和T2大小关系是T1____T2(填“>”、“<”或“=”),对应温度的平衡常数大小关系是K1____K2(填“>”、“<”或“=”)。
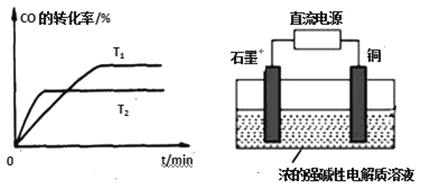
(3)用甲醇燃料电池作为直流电源,设计如图2装置制取Cu2O,写出铜电极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com