
【题目】下列物质与溴水混合振荡,溶液分层且上层有色、下层无色的是
A. 己烯 B. 甲苯 C. 乙醇 D. 四氯化碳
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中,正确的是
①常温下,15g甲醛(![]() )中含有的共用电子对总数为2NA
)中含有的共用电子对总数为2NA
②常温常压下,18gD2O中含有的电子总数为10NA
③将l00mL0.1mol·L-1的FeCl3溶液滴入沸水中,可制得Fe(OH)3胶粒0.0lNA.
④在反应KIO3+6HI===KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
⑤电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜
⑥1.7g的羟基与1.7g的氢氧根离子所含电子数均为0.9NA
A.①④
B.③④
C.②⑥
D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钾和金属钠的金属性相近,但K比Na略强,当利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的熔沸点:
K | Na | KCl | NaCl | |
熔点(℃) | 63.6 | 97.8 | 770 | 801 |
沸点(℃) | 774 | 882.9 | 1500 | 1413 |
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
A.低于770℃ B.850℃ C.高于882.9℃ D.1413~1500℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式为 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640.5 kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ι)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(2)某同学把新制的氯水加到NaNO2溶液中,请写出反应的离子方程式:________________。
(3)铝能溶解在碱性亚硝酸盐溶液中,生成能使湿润的红色石蕊变蓝的气体,请写出反应的离子方程式__________________;
(Ⅱ)某暗紫色化合物A在常温和干燥的条件下,可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。
下列物质中有可能提高化合物A水溶液稳定性的是 。
A.醋酸钠 B.醋酸 C.Fe(NO3)3 D.KOH
(2)请设计一个实验方案,研究温度对化合物A溶液稳定性的影响
(3)下图表示足量 Fe粉还原KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式:
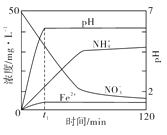
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由水电离出来的氢离子浓度为10-13 mol/L,在此溶液中一定能大量共存的离子组是
A. ClO—、K+、Cl— B. Ba2+、Na+、Br—
C. Na+、Fe3+、SO42— D. K+、NO3—、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),△H=-1025kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g),△H=-1025kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
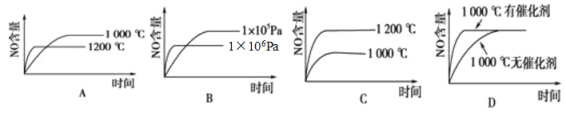
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com