


科目:高中化学 来源: 题型:
| A、Al3+ Na+NO3- Cl- |
| B、K+ Na+Cl- NO3- |
| C、K+ Na+ Cl-AlO2- |
| D、K+ NH4+ SO42-NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
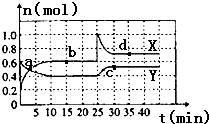 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入容积为2L的恒温密闭容器中,各组分物质的量随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入容积为2L的恒温密闭容器中,各组分物质的量随时间变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 物理量 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | |||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | |||
| ① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| ② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.010 | 4.0 | 25 | |||
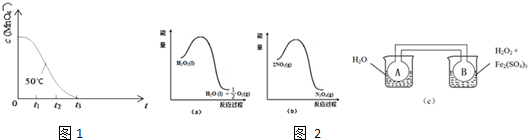
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用完后的废电池应该集中回收处理 |
| B、天然果汁中不含任何化学物质 |
| C、“绿色食品”指颜色为绿色的食品 |
| D、“白色污染”是白色粉尘造成的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅③不正确 |
| B、仅④不正确 |
| C、③④不正确 |
| D、②③④不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com