
【题目】将200mLH2SO4和Fe2(SO4)3的混合溶液分成两等份。向其中一份中加入足量铁粉,充分反应后测的固体质量减少4.48g;向另一份中加入足量BaCl2溶液,经过滤、洗涤、干燥、称量,得到46.6g白色沉淀。请计算:
(1)原溶液中c(SO42-)=______;
(2)原溶液中H2SO4和Fe2(SO4)3的物质的量浓度之比为______。
【答案】2.00mol/L 1:3
【解析】
(1)每份溶液的体积为100mL,生成的46.6g沉淀为BaSO4,其物质的量为:n(BaSO4)=![]() =0.2mool,原溶液中n(SO42-)=n(BaSO4)=0.2mol,则c(SO42-)=
=0.2mool,原溶液中n(SO42-)=n(BaSO4)=0.2mol,则c(SO42-)=![]() =2.00mol/L;
=2.00mol/L;
(2)固体质量减少的4.48g为Fe,其物质的量为:![]() =0.08mol,
=0.08mol,
设H2SO4和Fe2(SO4)3的物质的量分别为x、y,根据反应2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑可知:①x+y=0.08mol,
根据硫酸根离子守恒可知:②x+3y=0.2mol,
联立①②解得:x=0.02mol、y=0.06mol,
溶液具有均一性,则原溶液中H2SO4和Fe2(SO4)3的物质的量之比=0.02mol:0.06mol=1:3。


科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ | ⑩ |
(1)在这些元素中,⑩最高价氧化物的水化物为__________。
(2)写出①的最高价氧化物和②的单质的电子式_________,________。
(3)用电子式表示③与④形成化合物的过程______________________。
(4)①的单质和⑥的氧化物反应的化学方程式______________________。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:_____________________。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、HCO3、NO3 B.NH4+、SO42、Al3+、NO3
C.Na+、Ca2+、NO3、CO32 D.K+、MnO4、NH4+、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.NO是第一个被发现的生命体系气体信号分子,具有舒张血管的功能。工业上可用“氨催化氧化法”生产NO,主要副产物为N2。请回答下列问题:
(1)以氨气、氧气为原料,在催化剂存在下生成NO和副产物N2的热化学方程式如下:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)
4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)
2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)![]() 2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
(2)某化学研究性学习小组模拟工业合成NO的反应。在1110K时,向一恒容密闭容器内充入1mol NH3和2.8mol O2,加入合适催化剂(催化剂的体积大小可忽略不计),保持温度不变,只发生反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①下列各项能说明反应已达到化学平衡状态的是_______。(填字母序号)
a.5c(NH3)=4c(O2)
b.N-H键的生成速率与O-H键的生成速率相等
c.混合气体的压强不变
d.混合气体的密度不变
②若其他条件不变,将容器改为恒容的绝热容器,在达到平衡后的体系温度下的化学平衡常数为K1,则K1_____K(填“>”、“<”或“=”)。
II.(3)某化学研究性学习小组模拟用CO和H2合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_______,该温度下平衡常数K=_______。
III.(4)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极上的电极反应式为_____________。
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到5.6 L(标准状况)气体时,消耗甲烷的体积为________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)。
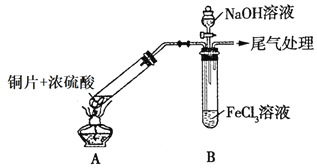
(1)图中盛放NaOH溶液的玻璃仪器名称是______。
(2)实验前,应先检查装置的______;实验开始后,A装置中试管内发生反应的化学方程式为______。实验中产生尾气可通入______(填写化学试剂)进行吸收处理。
(3)B试管中装有5mL1molL-1FeCl3溶液,往其中通入足量的SO2气体,B试管中的实验现象为______,写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. HOCH2COOH在一定条件下可与O2、 NaHCO3溶液、乙醇、乙酸发生反应,且反应类型相同
B. C2H3COOC2H5存在C4H9COOH时可以加入饱和NaOH溶液后分液除去
C. 金刚烷(如图结构)含有属于芳香化合物的同分异构体
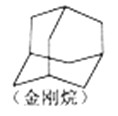
D. 与 NaHCO3溶液反应产生CO2的链状有机物C4H6O2,与HBr加成可生成5种同分异构体(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A. 非电解质:氨气、酒精、氯气
B. 混合物:盐酸、碱石灰、纯牛奶
C. 碱:烧碱、纯碱、氢氧化钡
D. 酸性氧化物:CO2、SiO2、Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
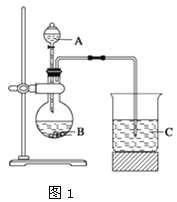
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。利用上述装置图1一次性完成Cl、C、Si三种非金属元素的非金属性强弱比较的实验研究。
(1)实验中选用的物质名称为:A____________,B__________,C____________;
(2)C处反应的离子方程式为________________。
(3)根据实验现象推知,可得出碳、硅、氯三种元素非金属性的强弱顺序是_____。
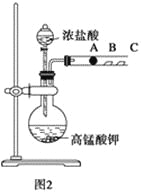
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气和Mn2+,利用上述装置图2探究卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。
(4)写出圆底烧瓶中发生反应的离子方程式:____________________。
(5)B处的实验现象为______________________________________________。
(6)根据A、B两处的实验现象能否推出非金属性Cl>Br>I,____(填“能”或“否”),原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚作为燃料电池的原料,可通过以下途径制取:
I.2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+H2O(g) ΔH
II.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
(1)已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g)![]() 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
则反应I的ΔH=_______kJ·mol-1
(2)在10L恒容密闭容器中,均充入4molCO2和7molH2,分别以铱(Ir)和铈(Ce)作催化剂,通过反应II制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1所示。
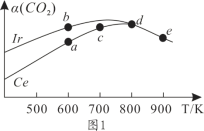
①根据图1,下列说法不正确的是________。
A.反应II的ΔH<0,ΔS>0
B.600K时,H2的速率:v(b)正>v(a)逆
C.分别用Ir、Ce作催化剂时,Ce使反应II的活化能降低更多
D.从状态d到e,α(CO2)减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=______(保留3位有效数字)。
(3)写出二甲醚碱性(电解质溶液为KOH溶液)燃料电池的负极电极反应式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com