
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、K+、SO42-、Cu2+、NO3- |
| B、Ag+、Fe3+、Cl-、SO42- |
| C、H+、I-、NO3-、SiO32- |
| D、NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | M | F | |
| 电离能 (kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
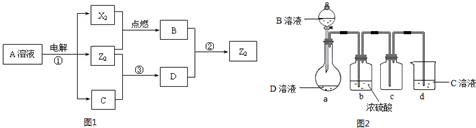
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
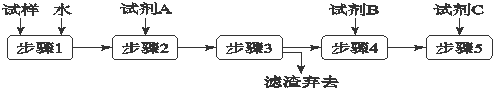
| A、步骤3的操作名称是过滤 |
| B、步骤1所需玻璃仪器是烧杯和玻璃棒 |
| C、试剂A是BaCl2溶液 |
| D、加入试剂A 的目的是除去CO32-并避免对Cl-或OH-的检验的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
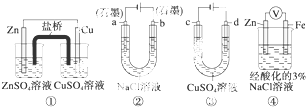
| A、装置①中,电池反应为Zn+Cu2+═Zn2++Cu |
| B、装置②工作一段时间后,a极附近溶液的pH增大 |
| C、用装置③精炼铜时,d极为粗铜 |
| D、装置④中电子由Zn流向Fe,Na+、H+移向Zn电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将CO2通入BaCl2溶液中至饱和,有沉淀产生 |
| B、在NaHCO3溶液中,加入澄清石灰水,有白色沉淀生成 |
| C、向AlCl3溶液中滴加浓氨水,产生白色沉淀;再加入过量浓氨水,沉淀仍不消失 |
| D、向FeCl2溶液中滴入KSCN溶液没有现象,再滴入氯水溶液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com