
| 元 素 | M | F | |
| 电离能 (kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
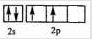 、
、 ,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素,结合元素对应原子的结构、单质及化合物的性质解答该题.
,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素,结合元素对应原子的结构、单质及化合物的性质解答该题. 、
、 ,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素;
,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素;
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
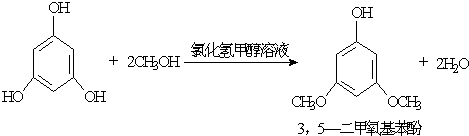
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | - | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | - | 0.7138 | 难溶于水 |
| 3,5-二甲氧基苯酚 | 172 | 36 | - | 易溶于甲醇、乙醚, 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
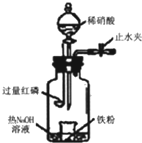 某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究.
某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
239 94 |
| A、原子序数是239 |
| B、质量数是94 |
| C、中子数是239 |
| D、质子数是94 |
查看答案和解析>>
科目:高中化学 来源: 题型:
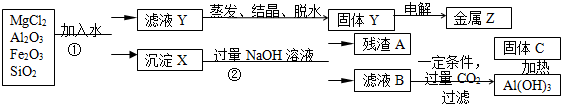
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用粮食酿酒的过程中,不可能生成乙酸 |
| B、乙醇和乙酸互为同分异构体 |
| C、氨基酸、蛋白质和纤维素均属于高分子化合物 |
| D、乙烯能使溴的四氯化碳溶液褪色,与乙烯分子含有碳碳双键有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com