
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,由这些元素组成的物质之间的转化关系如图所示,其中c、d为单质,a、b、g为二元化合物。b是10电子分子,g是18电子分子。下列说法正确的是

A. 同温同浓度的e和f溶液,后者pH较大
B. 含X、R、Z三种元素的化合物只有一种
C. 0.1mol的d与足量的e溶液反应转移电子数约为 1.204×1023
D. e和f含化学键类型相同
【答案】D
【解析】
由上述转化关系和条件易知,b是10电子分子,则为H2O,a应为氯化钠,题中通电过程实际是电解饱和氯化钠溶液生成H2、Cl2和NaOH,c、d为单质,且两者能反应生成18电子的g物质,应为HCl,d还可以与e反应,由此推出d应是Cl2,c是H2,g为HCl,Cl2可与NaOH反应生成NaCl、NaClO和H2O,所以f为NaClO,短周期主族元素R、X、Y、Z分别是H、O、Na、Cl,据此作答。
由上述分析可知,
A. e为NaOH,其水溶液为强碱,而f为NaClO,水解显碱性,则同温同浓度的两种溶液中,前者pH大,A项错误;
B. 含O、H、Cl三种元素的化合物有很多,如HClO、HClO3、HClO4等,B项错误;
C. Cl2可与NaOH反应生成NaCl、NaClO和H2O,则0.1mol的Cl2参加反应时,转移电子数为0.1 NA,即6.02×1023个,C项错误;
D. e为NaOH, f为NaClO,两者所含化学键均为离子键与极性键,D项正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。

下列说法正确的是( )
A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
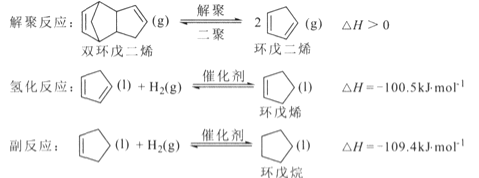
回答下列问题:
(l)反应![]() 的△H= _________ kJ/mol 。
的△H= _________ kJ/mol 。
(2)解聚反应在刚性容器中进行。
①其他条件不变,有利于提高双环戊二烯平衡转化率的条件是 ____ (填标号).
A.升高温度 B.降低温度 C.增大压强 D.减小压强
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为l00kPa的双环戊二烯和水蒸气,达到平衡后总压为160kPa,双环戊二烯的转化率为8 0%,则 pH2O=___kpa,平衡常数Kp=______kPa (Kp为以分压表示的平衡常数)
(3) 一定条件下,将环戊二烯溶于有机溶剂中进行氢化反应,反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如下图所示。

①将环戊二烯溶于有机溶剂中可减少二聚反应的发生,原因是____,
②最佳的反应时间为__h。活化能较大的是__(填“氢化反应”或“副反应”)。
(4)已知氢化反应平衡常数为1.6 × 1012,副反应的平衡常数为2.0×10l2。在恒温恒容下,环戊二烯与氢气按物质的量之比为1:1进行反应,则环戊二烯的含量随时间变化趋势是____(不考虑环戊二烯的二聚反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X(g)+2Y(g)![]() Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。

下列说法正确的是
A. 若反应①、②的平衡常数分别为K1、K2,则K1<K2
B. 实验②平衡时Y的转化率为60%
C. 减小反应③的压强,可以使平衡时c(X)=0.060 mol·L-1
D. 反应X(g)+2Y(g) ![]() Z(g)的ΔH>0
Z(g)的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。工厂计划用下列方案从该废水中回收FeSO4·7H2O晶体和金属铜。

请问答下列问题:
(1)试剂A为______,试剂D为____,固体B为_____。
(2)操作1的名称为_____,如何检验Cu已经洗涤干净_____;操作2为_____,冷却结晶,过滤。
(3)写出固体B与试剂D反应的化学方程式__________。
(4)不能用盐酸代替试剂D,原因是_________。
(5)某溶液中含有0.2 mol·L-1的NH![]() 、0.25 mol·L-1的Fe2+、0.4mol·L-1的Cl-及一定量的SO42-,则SO42-的物质的量浓度为_____。
、0.25 mol·L-1的Fe2+、0.4mol·L-1的Cl-及一定量的SO42-,则SO42-的物质的量浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列描述中所发生化学反应的离子方程式
(1)稀硫酸与氢氧化钡反应:_________________________________。
(2)向澄清石灰水中加入少量碳酸氢钠溶液:___________________________。
(3)向硫酸氢钠溶液中加氢氧化钠溶液至中性:____________________。
(4)生活中可以用醋酸除去水垢:________________________________________。
(5)西汉刘安《淮南万毕术》中记载“曾青得铁则化为铜”,是湿法炼铜的最早描述:______________________。
(6)向饱和的碳酸钠溶液中通入CO2生成碳酸氢钠的沉淀______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A.将“地沟油”进行分馏可得到汽油或柴油B.蛋白质不能发生氧化反应
C.淀粉和纤维素不互为同分异构体D.利用苯与溴水在铁粉作用下可制得溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在25 ℃条件下将pH=12的氨水稀释过程中,下列关系式正确的是________。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中![]() 比值增大
比值增大
D.此过程中Kw增大
②在25 ℃条件下将pH=12的氨水稀释100倍后溶液的pH为________(填序号)。
A.10 B.11 C.10~12 D.11~13
(2)25 ℃时,向0.1 mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是________(填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失)。
①________和________两种粒子的物质的量之和等于0.2 mol。
②________和________两种粒子的物质的量之和比OH-多0.1 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:
①红磷、白磷 ②![]() 、
、![]() ③
③![]() 、
、![]() ④
④![]() 、
、![]() ⑤
⑤![]() 、
、![]() ⑥
⑥![]() 、
、![]()
其中属于同位素的是______________,属于同素异形体的是___________,属于同种元素的不同种微粒的是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com