
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
| A.2v(NH2)=v(CO2) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
 NH4HCO2+NH3?H2O
NH4HCO2+NH3?H2O
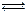
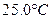 时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。
时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
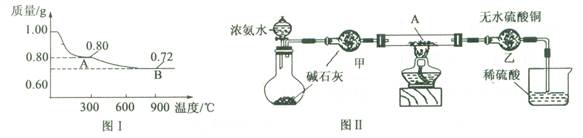
 Y中SO2的含量,设计如下三种方案:
Y中SO2的含量,设计如下三种方案: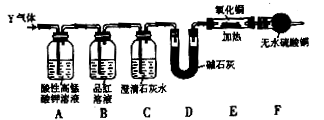
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

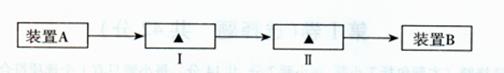
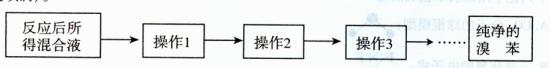
 。操作2目的: 。
。操作2目的: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
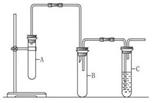
 -二氯乙烷已发生消去反应的现象是_______________,还可通过什
-二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。
么实验加以验证:________________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
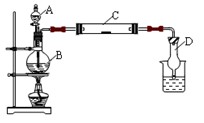

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 | 固体部分溶解。 |
| 步骤2: | |
| 步骤3: | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
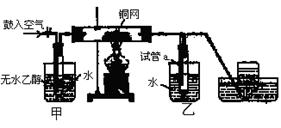
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com