
【题目】中南大学郑雅杰等3位老师提出“以含砷废水沉淀还原法制备As2O3”,有较高的实际应用价值。某工厂含砷废水含有H3AsO3、H2SO4、Fe2(SO4)3、Bi2(SO4)3等,利用该废水提取As2O3的流程如图所示。

表:金属离子沉淀pH值表格(20℃)
10-1 | 10-2 | 10-3 | 10-4 | 10-5 | |
Fe3+ | 1.8 | 2.2 | 2.5 | 2.9 | 3.2 |
Cu2+ | 4.7 | 5.2 | 5.7 | 6.2 | 6.7 |
(1)为了加快中和过程的速率,可以采取的措施有______________(写出一条合理的措施即可)。
(2)沉淀中的成分,除了Bi(OH)3沉淀外,还有_________。
(3)A可以循环利用,A的化学式为_________。在滤液1中,加入NaOH调节pH为8的目的是_______。
(4)Cu3(AsO3)2沉淀加入一定量的水调成浆料,通入SO2,该过程的化学反应方程式是__________。
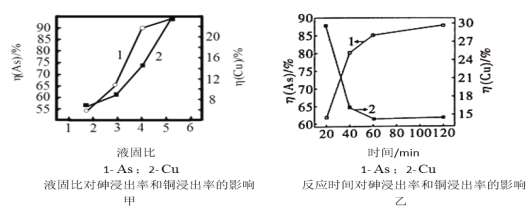
(5)按照一定的液固比,将水加入Cu3(AsO3)2沉淀中,调成浆料。当反应温度为25℃,SO2流量为16L/h,液固比、时间对砷、铜浸出率的影响如图甲、乙所示。请选择最适宜的液固比、反应时间:______________、_______________。
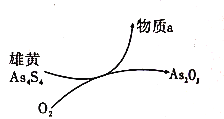
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为_______(填化学式)。
【答案】适当增加氢氧化钠溶液的浓度或加热 Fe(OH)3 CuSO4 完全沉淀Cu2+,回收利用铜 Cu3(AsO3)2+3SO2+6H2O=Cu3(SO3)2·2H2O+2H3AsO3+H2SO4 4:1 60min SO2
【解析】
(1)为了加快中和的速率,可以通过浓度、温度来调节反应的速率。
(2)根据元素守恒进行判断。
(3)Cu3(SO3)2·2H2O氧化可以得到CuSO4,在流程中可以循环利用。
(4)根据氧化还原反应中化合价升降守恒可知S的化合价升高,根据信息写出反应物和产物并配平方程式。
(5)根据图象,砷的浸岀率随着液固比增加而増加。为了减少铜的浸出,适宜的液固比为4:1。砷浸出率随反应时间延长而升高,铜浸出率随反应时间延长而降低。
(6)根据电子转移相等计算。
(1)为了加快中和的速率,可以通过浓度、温度来调节反应的速率,因此可以通过增加氢氧化钠溶液的浓度、加热来加快化学反应速率。
(2)根据含砷废水的成分H3AsO3、H2SO4、Fe2(SO4)3、Bi2(SO4)3等,根据元素守恒,除了得到Bi(OH)3沉淀外,还有Fe(OH)3沉淀。
(3)Cu3(SO3)2·2H2O氧化可以得到CuSO4,在流程中可以循环利用。Cu3(AsO3)2为了充分回收砷,使用了过量硫酸铜,为了减少铜的损失,应回收利用铜,用NaOH调节废水pH值至8。
(4)结合Cu3(AsO3)2中Cu为+2价,1molCu3(SO3)2·2H2O中有2molCu显+1价,1molCu显+2价,根据氧化还原反应中化合价升降守恒可知S的化合价升高,根据信息写出反应物和产物并配平方程式:Cu3(AsO3)2+3SO2+6H2O=Cu3(SO3)2·2H2O+2H3AsO3+H2SO4。
(5)根据图象,砷的浸岀率随着液固比增加而増加,但同时铜的浸岀率也随着液固比増加而升高。为了减少铜的浸出,适宜的液固比为4:1。砷浸出率随反应时间延长而升高,铜浸出率随反应时间延长市降低。当反应为60min时,砷浸出率较大和铜浸出率较小,继续延长反应时间,砷、铜浸出率变化不大。因此,选择60min。
(6)As4S4中As为+2价、S为-2价,且As元素被氧化为+3价的As2O3,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,由于As的化合价只升高了1,则S元素化合价必须升高6价,即S元素的化合价由-2升高为+4价,因此应为SO2。


科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
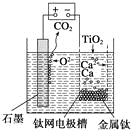
A. 由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X和Y为中学化学中的常见元素,其最高价含氧酸均为强酸。根据如图所示转化关系(反应条件及部分产物已略去),回答下列问题。
![]()
(1)若A、B、C、D均为含X的化合物,且A和F的分子中均含有10个电子,则:
①F的化学式为______。
②将1.92 g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12 L (标准状况),则反应消耗的D的物质的量为______mol。
(2)若A、B、C、D均为含Y的化合物,其中A由两种元素组成,且A的摩尔质量为34 g/mol,则:
①将铜粉与D的浓溶液反应所得的溶液加热蒸干,得到的白色固体物质为______(填化学式)。
②将Na2Y溶液滴加到次氯酸钠溶液中,有黄色沉淀生成,请写出所发生反应的离子方程式:______。在该反应中若有74.5 gNaClO被还原,则转移电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是( )
A. 1.4gB. 2.2gC. 4.4gD. 在2.2g和4.4g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH =﹣566 kJ/mol
2CO2(g) ΔH =﹣566 kJ/mol
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀。则混合气体中CH4和CO的体积比为( )
A.1∶2B.1∶3C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题涉及部分铜及其化合物的相关结构问题的考查,请回答下列问题。
(1)写出基态Cu2+的核外电子排布式:________。Cu的同周期元素中,与铜原子最外层电子数相等的元素原子还有___________(用元素符号表示)。
(2)从原子结构角度分析高温Cu2O比CuO稳定的原因是___________。
(3)[Cu(NH3)2]Ac可用于合成氨工业中的铜洗工序,除去进人合成塔前混合气中的CO(CO能使催化剂中毒)。
①Ac表示CH3COO-,Ac中碳原子的杂化方式为________。
②[Cu(NH3)2]Ac能够结合CO的原因是________。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
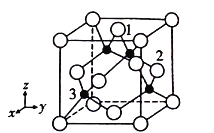
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于________填(“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(![]() ,
,![]() ,1),则原子2和3的坐标分别为___________、__________。
,1),则原子2和3的坐标分别为___________、__________。
③已知该晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与
与![]() 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
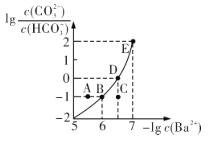
A.该溶液中![]()
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2O4(g)![]() 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上任何一点为对应压强下的平衡点),下列说法正确的是( )
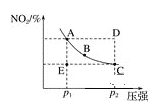
A. A、C两点的正反应速率的关系为A>C
B. A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C. 使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压到p2,再由p2无限缓慢降压至p1
D. 维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y;则x<y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气和汽车尾气含有多种氮氧化物,以NOx表示,NOx能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。按要求回答下列问题:
(1)NO2与N2O4存在以下转化关系:2NO2(g)![]() N2O4(g)。
N2O4(g)。
①已知:标准状况(25℃、101kPa)下,由最稳定的单质生成1mol化合物的焓变(或反应热),称为该化合物的标准摩尔生成焓。几种氧化物的标准摩尔生成焓如表所示:
物质 | NO(g) | NO2(g) | N2O4(g) | CO(g) |
标准摩尔生成焓/(kJ·mol-1) | 90.25 | 33.18 | 9.16 | -110.53 |
则NO2转化成N2O4的热化学方程式为__。
②将一定量N2O4投入固定容积的恒温容器中,下述现象能说明反应达到平衡状态的是__(填标号)。
A.v(N2O4)=2v(NO2) B.气体的密度不变
C.![]() 不变 D.气体的平均相对分子质量不变
不变 D.气体的平均相对分子质量不变
③达到平衡后,保持温度不变,将气体体积压缩到原来的一半,再次达到平衡时,混合气体颜色____填“变深”“变浅”或“不变”),判断理由是___。
(2)在容积均为2L的甲、乙两个恒容密闭容器中,分别充入等量NO2,发生反应:2NO2(g)![]() 2NO(g)+O2(g)。保持温度分别为T1、T2,测得
2NO(g)+O2(g)。保持温度分别为T1、T2,测得![]() n(NO2)与n(O2)随时间的变化如图所示:
n(NO2)与n(O2)随时间的变化如图所示:
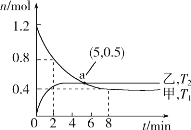
①T1时,反应从开始到第2min,平均速率v(O2)=__,该温度下平衡常数K=__。
②实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响,下列有关说法正确的是__(填标号)。
A.反应正向放热
B.a点处,v逆(甲)<v逆(乙)
C.k正(T2)>k正(T1)
D.温度改变,k正与k逆的比值不变
(3)硫代硫酸钠(Na2S2O3)在碱性溶液中是较强的还原剂,可用于净化氧化度较高的NOx废气,使之转化为无毒、无污染的N2。请写出NO2与硫代硫酸钠碱性溶液反应的离子方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com