
【题目】工业废气和汽车尾气含有多种氮氧化物,以NOx表示,NOx能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。按要求回答下列问题:
(1)NO2与N2O4存在以下转化关系:2NO2(g)![]() N2O4(g)。
N2O4(g)。
①已知:标准状况(25℃、101kPa)下,由最稳定的单质生成1mol化合物的焓变(或反应热),称为该化合物的标准摩尔生成焓。几种氧化物的标准摩尔生成焓如表所示:
物质 | NO(g) | NO2(g) | N2O4(g) | CO(g) |
标准摩尔生成焓/(kJ·mol-1) | 90.25 | 33.18 | 9.16 | -110.53 |
则NO2转化成N2O4的热化学方程式为__。
②将一定量N2O4投入固定容积的恒温容器中,下述现象能说明反应达到平衡状态的是__(填标号)。
A.v(N2O4)=2v(NO2) B.气体的密度不变
C.![]() 不变 D.气体的平均相对分子质量不变
不变 D.气体的平均相对分子质量不变
③达到平衡后,保持温度不变,将气体体积压缩到原来的一半,再次达到平衡时,混合气体颜色____填“变深”“变浅”或“不变”),判断理由是___。
(2)在容积均为2L的甲、乙两个恒容密闭容器中,分别充入等量NO2,发生反应:2NO2(g)![]() 2NO(g)+O2(g)。保持温度分别为T1、T2,测得
2NO(g)+O2(g)。保持温度分别为T1、T2,测得![]() n(NO2)与n(O2)随时间的变化如图所示:
n(NO2)与n(O2)随时间的变化如图所示:
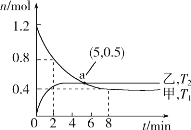
①T1时,反应从开始到第2min,平均速率v(O2)=__,该温度下平衡常数K=__。
②实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响,下列有关说法正确的是__(填标号)。
A.反应正向放热
B.a点处,v逆(甲)<v逆(乙)
C.k正(T2)>k正(T1)
D.温度改变,k正与k逆的比值不变
(3)硫代硫酸钠(Na2S2O3)在碱性溶液中是较强的还原剂,可用于净化氧化度较高的NOx废气,使之转化为无毒、无污染的N2。请写出NO2与硫代硫酸钠碱性溶液反应的离子方程式:__。
【答案】2NO2 (g)N2O4(g) △H=57.2 kJmol1 CD 0.05molL1min1 变深 压缩体积,平衡正向移动,n(NO2)减小,但体积减小对浓度的影响更大,因而c(NO2)增大,颜色变深 0.8 BC 2NO2+S2O32+2OH=N2↑+2SO42+H2O
【解析】
⑴①根据题意有I、N2(g) + 2O2(g)=2NO2(g) △H=33.18kJmol1×2=66.36 kJmol1,II、N2(g) + 2O2(g) = N2O4(g)△H=9.16 kJmol1,根据盖斯定律,II-I可得;②根据化学平衡时正逆反应速率相等,各组分含量不变分析;③根据影响化学平衡因素分析可得。
⑵①T1时,反应从开始到第2min,n(NO2)从1.2mol减少到0.8mol,则反应NO2消耗0.4mol,生成氧气为0.2mol,可得O2平均反应速率,建立三段式算平衡常数;②A. 根据图可知,乙先达到平衡,则T2>T1,平衡时,甲中氧气0.4mol,乙中氧气多于0.4mol,则温度升高,氧气生成多,即温度升高有利于正方向;B. T2>T1,a点处,v逆(甲)<v逆(乙);C. T2>T1,温度升高,反应速率快,k正(T2)>k正(T1);D. v正=k正c2(NO2),v逆=k逆c2(NO)c(O2),平衡时,v正=v逆,则![]() ,温度改变,K发生改变。
,温度改变,K发生改变。
⑶NO2与硫代硫酸钠在碱性条件下生成氮气和硫酸钠,据此书写。
(1)①根据题意有I、N2(g)+2O2 (g)=2NO2 (g)△H=33.18 kJmol1×2=66.36 kJmol1,II、N2 (g)+2O2 (g)=N2O4(g)△H=9.16kJ/mol,根据盖斯定律,III得:2NO2 (g)N2O4(g) △H=57.2 kJmol1;故答案为:2NO2 (g)N2O4(g) △H= 57.2 kJmol1。
②将一定量N2O4投入固定容积的恒温容器中,
A. v(N2O4)=2v(NO2),未说明正逆方向,故A错误;
B. 根据ρ=![]() ,气体的质量不变,容积固定,则密度始终不变,故B错误;
,气体的质量不变,容积固定,则密度始终不变,故B错误;
C. c(N2O4)、c(NO2)不变,反应达到平衡,故C正确;
D. 根据M=![]() ,混气质质量不变,反应2NO2(g)N2O4(g)气体的物质的量减小,则从N2O4投入平均相对分子质量增大,不变时,达到平衡,故D正确;综上所述,答案为:CD。
,混气质质量不变,反应2NO2(g)N2O4(g)气体的物质的量减小,则从N2O4投入平均相对分子质量增大,不变时,达到平衡,故D正确;综上所述,答案为:CD。
③达到平衡后,保持温度不变,将气体体积压缩到原来的一半,根据反应2NO2(g) N2O4(g),压缩体积,平衡正向移动,n(NO2)减小,但体积减小对浓度的影响更大,因而c(NO2)增大,再次达到平衡时,混合气体颜色变深;故答案为:变深;压缩体积,平衡正向移动,n(NO2)减小,但体积减小对浓度的影响更大,因而c(NO2)增大,颜色变深。
(2)①T1时,反应从开始到第2min,n(NO2)从1.2mol减少到0.8mol,则NO2反应了0.4mol,生成氧气为0.2mol,则v(O2)=0.2mol÷2L÷2min=0.05molL1min1;平衡时,n(NO2)为0.4mol,列三段式:

则![]() ;故答案为:0.05molL1min1;0.8。
;故答案为:0.05molL1min1;0.8。
②A. 根据图可知,乙先达到平衡,则T2>T1,平衡时,甲中氧气0.4mol,乙中氧气多于0.4mol,则温度升高,氧气生成多,即温度升高有利于正方向,正反应为吸热反应,故A错误;
B. T2>T1,a点处,v逆(甲)<v逆(乙),故B正确;
C. T2>T1,温度升高,反应速率快,k正(T2)>k正(T1),故C正确;
D. v正=k正c2(NO2),v逆=k逆c2(NO)c(O2),平衡时,v正=v逆,则![]() ,温度改变,K发生改变,则k正与k逆的比值变化,故D错误;
,温度改变,K发生改变,则k正与k逆的比值变化,故D错误;
综上所述,答案为BC。
(3)NO2与硫代硫酸钠在碱性条件下生成氮气和硫酸钠,离子反应为:2NO2+S2O32+2OH=N2↑+2SO42+H2O;故答案为:2NO2+S2O32+2OH=N2↑+2SO42+H2O。


科目:高中化学 来源: 题型:
【题目】中南大学郑雅杰等3位老师提出“以含砷废水沉淀还原法制备As2O3”,有较高的实际应用价值。某工厂含砷废水含有H3AsO3、H2SO4、Fe2(SO4)3、Bi2(SO4)3等,利用该废水提取As2O3的流程如图所示。

表:金属离子沉淀pH值表格(20℃)
10-1 | 10-2 | 10-3 | 10-4 | 10-5 | |
Fe3+ | 1.8 | 2.2 | 2.5 | 2.9 | 3.2 |
Cu2+ | 4.7 | 5.2 | 5.7 | 6.2 | 6.7 |
(1)为了加快中和过程的速率,可以采取的措施有______________(写出一条合理的措施即可)。
(2)沉淀中的成分,除了Bi(OH)3沉淀外,还有_________。
(3)A可以循环利用,A的化学式为_________。在滤液1中,加入NaOH调节pH为8的目的是_______。
(4)Cu3(AsO3)2沉淀加入一定量的水调成浆料,通入SO2,该过程的化学反应方程式是__________。
(5)按照一定的液固比,将水加入Cu3(AsO3)2沉淀中,调成浆料。当反应温度为25℃,SO2流量为16L/h,液固比、时间对砷、铜浸出率的影响如图甲、乙所示。请选择最适宜的液固比、反应时间:______________、_______________。
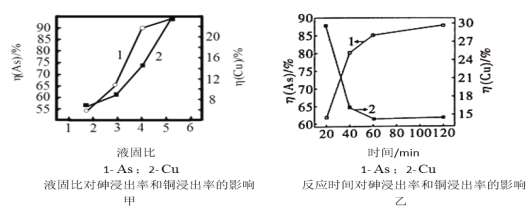
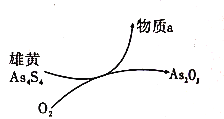
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式 2SO3(g)![]() 2SO2(g) + O2(g);△H1 = +197kJ/mol, 热化学方程式:2SO2(g) + O2(g)
2SO2(g) + O2(g);△H1 = +197kJ/mol, 热化学方程式:2SO2(g) + O2(g)![]() 2SO3(l);△H2 = — a kJ/mol 则下列说法正确的是( )
2SO3(l);△H2 = — a kJ/mol 则下列说法正确的是( )
A.a>197
B.a<197
C.a=197
D.热方程式中化学计量数可表示分子个数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯的主链含有-NHCOO-重复单元的一类新型高分子化合物,其单体是氰酸酯(如O=C=N-R-N=C=O)和多元醇(如HO-R’-OH)。其高聚物结构式如图所示:
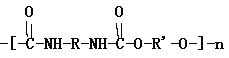
(1)由上述异氰酸酯和多元醇合成高聚物的反应属于___反应(填“加聚”,“缩聚”)。
(2)写出由2,6-甲基苯二异氰酸酯(如图所示) 和1,3-丙二醇为单体生成高聚物的化学方程式:___。
和1,3-丙二醇为单体生成高聚物的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是

A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为![]() ,下列有关咖啡酸的说法中,不正确的是( )
,下列有关咖啡酸的说法中,不正确的是( )
A.咖啡酸遇FeCl3溶液显紫色
B.咖啡酸可以发生加成、酯化、加聚等反应
C.1mol咖啡酸最多能与3molNaOH发生反应
D.1mol咖啡酸与饱和溴水反应,最多消耗2molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为_____;D和E的电负性大小关系为____(用元素符号表示)。
(2)化合物E2D分子的空间构型为____________________,中心原子采用_____________杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_______,任意写出一种它的等电子体的化学式为____________。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于____晶体,晶体内含有的作用力类型有__________。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为______。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如下图所示(反应条件已略去)。下列说法错误的是
![]()
A.原子半径由大到小的顺序为:D>B>C>A
B.简单氢化物的沸点:B<C
C.d与m反应的现象为浮在液面上四处游动
D.C与D形成的化合物中一定含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com