
����Ŀ����֪X��YΪ��ѧ��ѧ�еij���Ԫ�أ�����ۺ������Ϊǿ�ᡣ������ͼ��ʾת����ϵ(��Ӧ���������ֲ�������ȥ)���ش��������⡣
![]()
(1)��A��B��C��D��Ϊ��X�Ļ������A��F�ķ����о�����10�����ӣ���
��F�Ļ�ѧʽΪ______��
�ڽ�1.92 gͭ����һ������D��Ũ��Һ��Ӧ����ͭ����ȫ��Ӧʱ�ռ�������1.12 L (��״��)����Ӧ���ĵ�D�����ʵ���Ϊ______mol��
(2)��A��B��C��D��Ϊ��Y�Ļ��������A������Ԫ����ɣ���A��Ħ������Ϊ34 g/mol����
�ٽ�ͭ����D��Ũ��Һ��Ӧ���õ���Һ�������ɣ��õ��İ�ɫ��������Ϊ______(�ѧʽ)��
�ڽ�Na2Y��Һ�μӵ�����������Һ�У��л�ɫ�������ɣ���д����������Ӧ�����ӷ���ʽ��______���ڸ÷�Ӧ������74.5 gNaClO����ԭ����ת�Ƶ��ӵ����ʵ���Ϊ______mol��
���𰸡�H2O 0.11 CuSO4 S2-+ClO-+H2O=S��+Cl-+2OH- 2
��������
��֪X��YΪ��ѧ��ѧ�еij���Ԫ�أ�X��Y����Ԫ������������ˮ�����Ϊǿ�ᡣ
(1)��A��B��C��D��Ϊ��XԪ�صĻ������A��F�ķ����о�����10�����ӣ���A��NH3��B��NO��C��NO2��D��HNO3��EΪO2��FΪH2O��
��������������֪��FΪH2O��
��Cu��Ũ���ᷴӦ����Cu(NO3)2��NO2��H2O������Cu����������Cu�����ʵ�����HNO3������Ϊ��������������ã����ݵ�Ԫ���غ���㷴Ӧ����HNO3�����ʵ�����
(2)��A��B��C��D��Ϊ��Y�Ļ��������A������Ԫ����ɣ���A��Ħ������Ϊ34 g/mol����YԪ��ΪSԪ�أ���A��H2S��B��SO2��C��SO3��D��H2SO4��E��O2��F��H2O��
��ͭ�����ᷴӦ��������ͭ������������ˮ�����õ���Һ������ͭ��Һ���������ɵõ��İ�ɫ����������CuSO4��
�ڻ�����Na2S�ʹ���������Һ��ǿ���Ի������ܷ�����Ӧ������Ϊ��ɫ��������Ȼ�����ˮ����ϻ��ϼ۵ı仯���
������������֪X��NԪ�أ�Y��SԪ�ء�
(1) A��NH3��B��NO��C��NO2��D��HNO3��EΪO2��FΪH2O��
��F��ˮ����ѧʽΪH2O��
��1.92 gCu�����ʵ���Ϊn(Cu)= ![]() =0.03 mol��Cu��Ũ���ᷴӦ����Cu(NO3)2��NO2��H2O������Ӧ���е�һ���̶ȣ���Ϊϡ���ᣬ��Ӧ����Cu(NO3)2��NO��H2O����Ӧ����������NO��NO2�����ʵ���n=1.12 L��22.4 L/mol=0.05 mol����Ӧ����Cu(NO3)2�����ʵ���Ϊ0.03 mol�����ݵ�Ԫ���غ㣬���ĵ���������ʵ���Ϊ0.03 mol��2+0.05 mol=0.11 mol��
=0.03 mol��Cu��Ũ���ᷴӦ����Cu(NO3)2��NO2��H2O������Ӧ���е�һ���̶ȣ���Ϊϡ���ᣬ��Ӧ����Cu(NO3)2��NO��H2O����Ӧ����������NO��NO2�����ʵ���n=1.12 L��22.4 L/mol=0.05 mol����Ӧ����Cu(NO3)2�����ʵ���Ϊ0.03 mol�����ݵ�Ԫ���غ㣬���ĵ���������ʵ���Ϊ0.03 mol��2+0.05 mol=0.11 mol��
(2)YԪ��ΪSԪ�أ�A��H2S��B��SO2��C��SO3��D��H2SO4��E��O2��F��H2O��
��ͭ��Ũ���ᷴӦ����CuSO4��SO2��H2O�����õ���Һ������ͭ��Һ���������ɵõ���������CuSO4��
�ڻ�����Na2S���л�ԭ�ԣ���NaClO���������ԣ�������ǿ���Ի������ܷ�����Ӧ��������ɫ��������ó���ΪS��S2-����������S��ClO-����ԭ����Cl-��ͬʱ��ˮ���ɣ��÷�Ӧ�����ӷ�Ӧ����ʽ��S2-+ClO-+H2O=S��+Cl-+2OH-���ڷ�Ӧ��ÿ��1 mol NaClO��Ӧ��ת��2 mol���ӣ�74.5 g NaClO�����ʵ���n(NaClO)= ![]() =1 mol����Ӧת�Ƶ��ӵ����ʵ���Ϊ2 mol��
=1 mol����Ӧת�Ƶ��ӵ����ʵ���Ϊ2 mol��


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪�ú��������ķ�Һ(����������)���Ʊ�Ħ���Σ���(NH4)2Fe(SO4)2��6H2O��������������£�
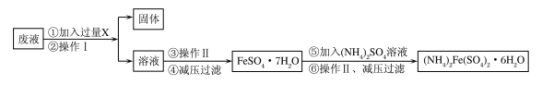
�ش��������⣺
���Լ�X��_______�������������Ϊ��____��
�ڼ�ѹ���˵�Ŀ���ǣ�____��
��Ϊ�ⶨ(NH4)2Fe(SO4)2��6H2O���������ĺ�����ijʵ��С����������ʵ�飺�õ�����ƽȷ����5.000g��������茶��壬���Ƴ�250mL��Һ��ȡ������Һ25.00mL����ƿ�У���ϡH2SO4�ữ����0.01000mol/LKMnO4��Һ�ζ����������KMnO4��Һ��ƽ�����Ϊ23.00mL���ζ��յ������Ϊ��_____________________________���þ�����������������Ϊ___________��(����4λ��Ч����)
(2)ij������ͨ��ʵ�����Ħ���ξ������ʱ�ķֽ���
��Ħ�������ȷֽ⣬С��ͬѧ��Ϊ�ֽ������������¼��������
a��Fe2O3��SO3��NH3��H2O b��FeO��SO2��NH3��H2O
c��FeO��NH3��SO3��H2O d��Fe2O3��NH3��SO2��SO3��H2O
�����������ͨ����������ȷ��������___________������(�����)��
����ͬѧ�������ͼװ�ã�����Aװ���еĹ����Ϊ����ɫ�����������к���______Cװ���к�ɫ��ȥ��˵����������к���__________��
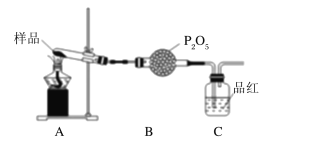
�۱�ͬѧ����������װ��֤���ֽ�����к��а�����ֻ�����B��C�е��Լ����ɣ����������Լ�ΪB��______________��C�з�̪��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���ε�ȱ������ͨ����ʳ�������������ĵ����(![]() )������غ͵⻯������Һ���ܷ������·�Ӧ��
)������غ͵⻯������Һ���ܷ������·�Ӧ��![]() �������й�������ȷ����( )
�������й�������ȷ����( )
A.�÷�Ӧ��������Ϊ![]() ����ԭ��Ϊ
����ԭ��Ϊ![]()
B.�÷�Ӧ�У�ÿ����3mol![]() ʱת�Ƶĵ�����ĿΪ5NA
ʱת�Ƶĵ�����ĿΪ5NA
C.������Ӧ�У����������뻹ԭ���������֮��Ϊ1:5
D.ֱ����ʳ���м��������Һ�������жϸ�ʳ���Ƿ�Ϊ�ӵ�ʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ϡHNO3�пɷ������·�Ӧ��3Fe3O4+28HNO3=9Fe(NO3)x+NO��+14H2O�������ж���ȷ����( )
A. Fe(NO3)x���е�xΪ![]()
B.��Ӧ��ÿ����0.2 mol��ԭ�������0.6 mol����ת��
C. HNO3�ڷ�Ӧ��ֻ����������
D.�����������е���Ԫ��ȫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧС��ʵ��̽��SO2��AgNO3��Һ�ķ�Ӧ��
��1��ʵ��һ��������װ�ã��г֡����������ԣ��Ʊ�SO2��������SO2ͨ��AgNO3��Һ�У�Ѹ�ٷ�Ӧ���õ���ɫ��ҺA�Ͱ�ɫ����B��

��ŨH2SO4��Cu��Ӧ�Ļ�ѧ����ʽ��____________________________________��
���Լ�a��____________��
��2������ϵ���й��������ʷ����ó�������B����ΪAg2SO3��Ag2SO4�������������ϣ�Ag2SO4����ˮ��Ag2SO3������ˮ��
ʵ�������֤B�ijɷ�

��д��Ag2SO3���ڰ�ˮ�����ӷ���ʽ��__________��
�ڼ�����������D���ܽ⣬ʣ����������F���ƶ�D����Ҫ��BaSO3�������ƶ�B�к���Ag2SO3������ҺE�м���һ���Լ����ɽ�һ��֤ʵB�к���Ag2SO3�������Լ���������__________��
��3�����ݳ���F�Ĵ��ڣ��Ʋ�![]() �IJ���������;����
�IJ���������;����
;��1��ʵ��һ�У�SO2��AgNO3��Һ�б���������Ag2SO4�������B����D��
;��2��ʵ����У�![]() ������Ϊ
������Ϊ![]() ����D��
����D��
ʵ������̽��![]() �IJ���;��
�IJ���;��
������ҺA�е���������ᣬ������ɫ������֤����Һ�к���________��ȡ�ϲ���Һ�����μ�BaCl2��Һ��δ���ְ�ɫ���������ж�B�в���Ag2SO4�������жϵ����ɣ�_______��
��ʵ�����Ľ��ۣ�__________��
��4��ʵ��һ��SO2��AgNO3��Һ��Ӧ�����ӷ���ʽ��_________________��
��5�������������ʷ�����SO2��AgNO3��ҺӦ�ÿ��Է���������ԭ��Ӧ����ʵ��һ���û�������һ��ʱ�䣬��Ag��![]() ���ɡ�
���ɡ�
��6����������ʵ�����ý��ۣ�__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����![]() �İ�ˮ�μӵ�
�İ�ˮ�μӵ�![]() �������У�����˵����ȷ���� �� ��
�������У�����˵����ȷ���� �� ��
A.�������Һ��![]() ����
����![]()
B.�����Һ��![]() ����
����![]()
C.�����Һ��![]() ������Һ��pH��7
������Һ��pH��7
D.��![]() ���һ��Һ��pH��7����һ��
���һ��Һ��pH��7����һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��˵����������������ʵ��ǣ� ��
��25��ʱ����������Һ��pH����7 ����HNO2��Һ���������飬���ݺܰ� ��HNO2��Һ����Na2SO4��Һ��Ӧ ��0.1mol��L-1HNO2��Һ��pH��2
A.�٢ڢ�
B.�ڢۢ�
C.�٢�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϴ�ѧ֣�Žܵ�3λ��ʦ������Ժ����ˮ������ԭ���Ʊ�As2O3�����нϸߵ�ʵ��Ӧ�ü�ֵ��ij���������ˮ����H3AsO3��H2SO4��Fe2(SO4)3��Bi2(SO4)3�ȣ����ø÷�ˮ��ȡAs2O3��������ͼ��ʾ��

�����������ӳ���pHֵ����(20��)
10-1 | 10-2 | 10-3 | 10-4 | 10-5 | |
Fe3+ | 1.8 | 2.2 | 2.5 | 2.9 | 3.2 |
Cu2+ | 4.7 | 5.2 | 5.7 | 6.2 | 6.7 |
(1)Ϊ�˼ӿ��к��̵����ʣ����Բ�ȡ�Ĵ�ʩ��______________(д��һ�������Ĵ�ʩ����)��
(2)�����еijɷ֣�����Bi(OH)3�����⣬����_________��
(3)A����ѭ�����ã�A�Ļ�ѧʽΪ_________������Һ1�У�����NaOH����pHΪ8��Ŀ����_______��
(4)Cu3(AsO3)2��������һ������ˮ���ɽ��ϣ�ͨ��SO2���ù��̵Ļ�ѧ��Ӧ����ʽ��__________��
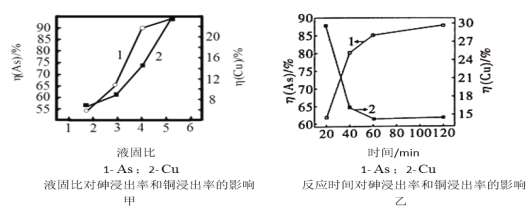
(5)����һ����Һ�̱ȣ���ˮ����Cu3(AsO3)2�����У����ɽ��ϡ�����Ӧ�¶�Ϊ25�棬SO2����Ϊ16L/h��Һ�̱ȡ�ʱ����顢ͭ�����ʵ�Ӱ����ͼ�ס�����ʾ����ѡ�������˵�Һ�̱ȡ���Ӧʱ�䣺______________��_______________��
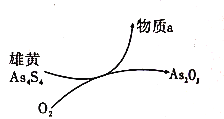
(6)һ�������£����ۻ�(As4S4)�Ʊ�As2O3��ת����ϵ��ͼ��ʾ������Ӧ�У�1mol As4S4(����AsԪ�صĻ��ϼ�Ϊ+2��)�μӷ�Ӧʱ��ת��28mole-��������aΪ_______(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ 2SO3(g)![]() 2SO2(g) + O2(g)����H1 �� +197kJ/mol�� �Ȼ�ѧ����ʽ:2SO2(g) + O2(g)
2SO2(g) + O2(g)����H1 �� +197kJ/mol�� �Ȼ�ѧ����ʽ:2SO2(g) + O2(g)![]() 2SO3(l)����H2 �� �� a kJ/mol ������˵����ȷ���ǣ� ��
2SO3(l)����H2 �� �� a kJ/mol ������˵����ȷ���ǣ� ��
A.a��197
B.a��197
C.a��197
D.�ȷ���ʽ�л�ѧ�������ɱ�ʾ���Ӹ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com