
【题目】(1)已知用含硫酸铁的废液(含少量杂质)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:
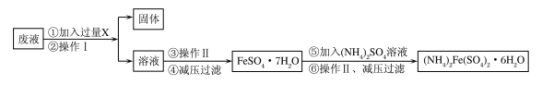
回答下列问题:
①试剂X是_______,操作Ⅰ的名称为:____。
②减压过滤的目的是:____。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/LKMnO4溶液滴定,测得消耗KMnO4溶液的平均体积为23.00mL。滴定终点的现象为:_____________________________;该晶体中铁的质量分数为___________。(保留4位有效数字)
(2)某课题组通过实验检验摩尔盐晶体加热时的分解产物。
①摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O b.FeO、SO2、NH3、H2O
c.FeO、NH3、SO3、H2O d.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想___________不成立(填序号)。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______C装置中红色褪去,说明气体产物中含有__________。
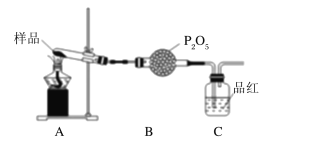
③丙同学想利用上述装置证明分解产物中含有氨气。只需更换B、C中的试剂即可,则更换后的试剂为B中______________、C中酚酞溶液。
【答案】Fe; 过滤; 降低沸点,减少能量损耗; 滴入最后一滴酸性KMnO4溶液,溶液颜色由无色变为浅红色,且半分钟内部变色。 12.88%; ab; Fe2O3; SO3; 碱石灰。
【解析】
硫酸铁与铁反应生成硫酸亚铁,过滤后分离滤液和滤渣,为得到七水硫酸亚铁晶体需要蒸发浓缩、冷却结晶。减压过滤的目的是降低沸点,减少能量损耗。滴定过程中,由于是用逐滴酸性KMnO4滴定Fe2+的浓度,则终点的现象为滴入最后一滴酸性KMnO4溶液,溶液颜色由无色变为浅红色,且半分钟内部变色。
(1) ①试剂X是Fe,操作Ⅰ的名称为过滤;
②减压过滤的目的为降低沸点,减少能量损耗;
③滴定过程中,由于是用逐滴酸性KMnO4滴定Fe2+的浓度,则终点的现象为滴入最后一滴酸性KMnO4溶液,溶液颜色由无色变为浅红色,且半分钟内部变色;
根据方程式中转移电子守恒,5Fe2+ ~ KMnO4,则250mL溶液中n(Fe2+)=5n(KMnO4)=5×0.023L×0.01mol/L×10=0.0115mol;质量为0.644g;则质量分数为12.88%;
(2) ①摩尔盐受热分解,可能会发生氧化还原反应,
a.Fe2O3、SO3、NH3、H2O 中只有Fe的化合价升高,没有化合价降低,所以a不成立;b.FeO、SO2、NH3、H2O中只有S的化合价降低,没有化合价升高,所以b不成立;
c.FeO、NH3、SO3、H2O中没有化合价变化,c成立;
d.Fe2O3、NH3、SO2、SO3、H2O中化合价的升高和降低,d成立
综上,猜想ab不成立;
②题意中固体呈红棕色,则产物中含有Fe2O3,C装置中品红褪色,说明气体产物中含有SO2;
③证明分解产物中含有氨气,B应该除去SO2,所以B中试剂为碱石灰; C中酚酞溶液检验NH3。


科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常数
H2O(g)+CO2(g)的平衡常数![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是( )
A.②④⑥B.①③④C.①③⑤⑥D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B+、C–、D、E五种粒子(分子和离子)中,每个粒子均有10个电子。已知:①A++C–=E+D②B++C–=2D
(1)C–离子的电子式是_________
(2)具有相同空间构型的粒子______和______,E分子的空间构型为_________,_______性分子。
(3)分别写出A+和D反应、B+和E反应的离子方程式_____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。请回答下列问题:
(1)第一电离能介于B和N之间的第二周期的元素共有________种。
(2)基态K+离子电子占据最高能级的电子云轮廓图为_________形。
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下BeCl2以双聚分子存在,其结构式为________,其中Be原子的电子排布图为_________。
(4)四氟硼酸钠(NaBF4)是纺织工业的催化剂。其阴离子的中心原子的杂化轨道类型为_________。四氟硼酸钠中存在_______(填序号):
a. 氢键 b. 范德华力 c. 离子键 d. 配位键 e. σ键 f. π键
查看答案和解析>>
科目:高中化学 来源: 题型:
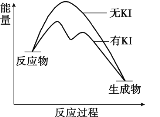
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中都分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+ Y(?)![]() a Z(g)。
a Z(g)。
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断不正确的是
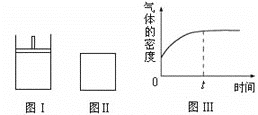
A. 物质Z的化学计量数a =1
B. 若X、Y均为气态,则在平衡时X的转化率:Ⅰ>Ⅱ
C. 若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D. 若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
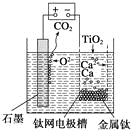
A. 由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X和Y为中学化学中的常见元素,其最高价含氧酸均为强酸。根据如图所示转化关系(反应条件及部分产物已略去),回答下列问题。
![]()
(1)若A、B、C、D均为含X的化合物,且A和F的分子中均含有10个电子,则:
①F的化学式为______。
②将1.92 g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12 L (标准状况),则反应消耗的D的物质的量为______mol。
(2)若A、B、C、D均为含Y的化合物,其中A由两种元素组成,且A的摩尔质量为34 g/mol,则:
①将铜粉与D的浓溶液反应所得的溶液加热蒸干,得到的白色固体物质为______(填化学式)。
②将Na2Y溶液滴加到次氯酸钠溶液中,有黄色沉淀生成,请写出所发生反应的离子方程式:______。在该反应中若有74.5 gNaClO被还原,则转移电子的物质的量为______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com