
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
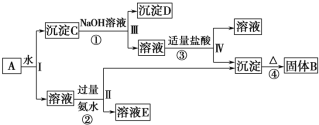
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是__。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B__;沉淀C__;沉淀D__;溶液E___。
(3)写出①、②、③、④四个反应的化学方程式或离子方程式
①__;
②___;
③___;
④__。
【答案】过滤 Al2O3 Al2O3、Fe2O3 Fe2O3 K2SO4、(NH4)2SO4 Al2O3+2NaOH=2NaAlO2+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ NaAlO2+HCl+H2O=Al(OH)3↓+NaCl 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C为Al2O3和Fe2O3;由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,然后结合物质的性质及化学用语来解答。
(1)溶液和沉淀的分离利用过滤;
(2)由上述分析可知B为Al2O3,C为Al2O3、Fe2O3,D为Fe2O3溶液E为K2SO4、(NH4)2SO4;
(3)反应①为Al2O3+2NaOH=2NaAlO2+H2O;
反应②为Al3++3NH3H2O=Al(OH)3↓+3NH4+;
反应③为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
反应④为2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )
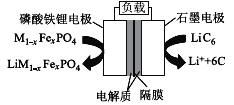
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式_________________________________。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________(填“较大”或“常压”)。其中温度与气体产率的关系如图:

①约650℃之前,脱酸基反应活化能低速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时______________________。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请用化学方程式表示:_________________________________。
(3)若利用合适的催化剂控制其他的副反应,温度为TK时达到平衡,总压强为PkPa,热裂解反应消耗乙酸20%,脱酸基反应消耗乙酸60%,乙酸体积分数为___________(计算结果保留l位小数);脱酸基反应的平衡常数Kp为___________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是
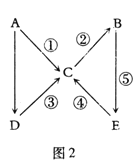
A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,M(OH)2在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.25℃时,M(OH)2的溶度积常数Ksp为1x10-8
B.向饱和M(OH)2溶液中加入NaOH固体不能使溶液由Z点变为X点
C.25℃时,M(OH)2在水中的溶度积和溶解度比其在KOH溶液中的大
D.升高温度,可使溶液由Y点变为X点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H = -169kJ·mol-1,②C(s)+
O2(g)=Cu2O(s)△H = -169kJ·mol-1,②C(s)+![]() O2(g)=CO(g)△H = -110.5kJ·mol-1,③ Cu(s)+
O2(g)=CO(g)△H = -110.5kJ·mol-1,③ Cu(s)+![]() O2(g)=CuO(s)△H = -157kJ·mol-1,则方法a发生的热化学方程式是:____________。
O2(g)=CuO(s)△H = -157kJ·mol-1,则方法a发生的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为____离子交换膜(填“阴”或“阳”),该电池的阳极反应式为_____,钛极附近的pH值________(填“增大”“减小”或“不变”)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:![]() △H>0。水蒸气的浓度随时间t变化如下表所示:
△H>0。水蒸气的浓度随时间t变化如下表所示:
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | p>T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2_________T1(填“﹥”“﹤”或“﹦”),能否通过对比实验①③到达平衡所需时间长短判断:_________(填 “能”或“否”)。
②实验①前20 min的平均反应速率 v(O2)=_________
③催化剂的催化效率:实验①___________实验②(填“﹥”或“﹤”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq) ΔH。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
I3-(aq) ΔH。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
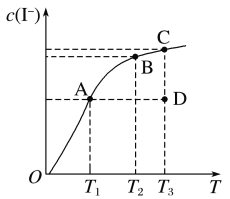
A.该反应ΔH>0
B.若反应进行到状态D时,一定有v正>v逆
C.若在T1、T2温度下,反应的平衡常数分别为K1、K2,则K1>K2
D.状态A与状态B相比,状态A的c(I3-)大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com