
【题目】土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.某兴趣小组以黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示. 
已知:黏土的主要成分为2CaO3Al2O3FeOFe2O310SiO2nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
(1)为提高酸浸速率,除适当增大硫酸浓度外,还可采取的措施有(任写一条).
(2)向滤液Ⅰ中加入H2O2的作用是;用CaCO3调节溶液pH约为3.3,其目的是 .
(3)红色水泥添加剂的主要成分是 .
(4)物质X的化学式为 .
(5)气体M的电子式为;向滤液Ⅲ中加入CaO的作用是(任写一条).
(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3 ![]() Al2O3+3H2O、 .
Al2O3+3H2O、 .
【答案】
(1)搅拌、适当升温、将废渣碾细成粉末
(2)将滤液中的Fe2+氧化为Fe3+;使Fe3+完全转化为Fe(OH)3沉淀而除去
(3)Fe2O3
(4)CaSO4?2H2O
(5)![]() ;与水反应放热,降低NH3的溶解度
;与水反应放热,降低NH3的溶解度
(6)Al2O3+N2+3C ![]() 2AlN+3CO
2AlN+3CO
【解析】解:根据流程图:黏土的主要成分为2CaO3Al2O3FeOFe2O310SiO2nH2O与硫酸反应生成硫酸钙、硫酸铝、硫酸亚铁、硫酸铁,加入双氧水将Fe2+氧化为Fe3+ , 加CaCO3调节pH使Fe3+完全转化为Fe(OH)3沉淀而除去,得到滤渣Ⅱ为氢氧化铁,加热得红色水泥添加剂的主要成分为Fe2O3 , 滤液Ⅱ中含硫酸钙、硫酸铝、加氨水,铝离子及大量钙离子转化为沉淀进入滤渣Ⅲ,滤液Ⅲ中主要含一水合氨、硫酸铵,加入CaO,与水反应放热,NH3的溶解度降低,得气体M为NH3 , 滤液含硫酸钙,蒸发结晶得物质X为CaSO42H2O,CaSO42H2O与石灰石、黏土制水泥,(1)为提高酸浸速率,即加快反应速率,除适当增大硫酸浓度外,还可通过搅拌、适当升温、将废渣碾细成粉末可加快反应速率,所以答案是:搅拌、适当升温、将废渣碾细成粉末;(2)根据表格中部分难溶物开始沉淀时和完全沉淀时的pH,可知要除去Fe2+需将其氧化为Fe3+ , 故向滤液Ⅰ中加入H2O2的作用是过氧化氢具有强氧化性,可将具有还原性的Fe2+氧化为Fe3+ , 易于转化为Fe(OH)3而除去,用CaCO3调节溶液pH约为3.3,其目的是使Fe3+完全转化为Fe(OH)3沉淀而除去;
所以答案是:将滤液中的Fe2+氧化为Fe3+;使Fe3+完全转化为Fe(OH)3沉淀而除去;(3)根据流程图滤渣Ⅱ为氢氧化铁,加热得红色水泥添加剂的主要成分为Fe2O3 ,
所以答案是:Fe2O3;(4)根据流程图,物质X为B滤液含硫酸钙经蒸发结晶所得,且物质X与石灰石、黏土制水泥故物质X为CaSO42H2O,
所以答案是:CaSO42H2O;(5)根据流程图滤液Ⅲ中主要含一水合氨、硫酸铵,加入CaO,与水反应放热,NH3的溶解度降低,得气体M为NH3 , 且气体M可制得氨水,故气体M为NH3 ,
所以答案是: ![]() ;与水反应放热,降低NH3的溶解度;(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,根据流程图滤渣Ⅲ含Al(OH)3 , 经加热得Al2O3 , Al2O3 , 与碳及氮气制得氮化铝及生成CO,
;与水反应放热,降低NH3的溶解度;(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,根据流程图滤渣Ⅲ含Al(OH)3 , 经加热得Al2O3 , Al2O3 , 与碳及氮气制得氮化铝及生成CO,
所以答案是:Al2O3+N2+3C ![]() 2AlN+3CO.
2AlN+3CO.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)按系统命名法命名. ①有机物CH3CH(C2H5)CH(CH3)2的名称是 .
②在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”. C7H16的同分异构体中具有“手性碳原子”的有种,写出其中一种的名称 .
(2)写出下列各种有机物的结构简式 ①2,3﹣二甲基﹣4﹣乙基已烷
②支链只有一个乙基且式量最小的烷烃 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化镁(MgH2)既可用于劣质燃料的助燃又可同时脱硫脱硝.有关原理如下:
MgH2(s)Mg(s)+H2(g)△H1
2Mg(s)+O2(g)2MgO(s)△H2
2MgO(s)+2SO2(g)2MgSO4(s)△H3
(1)①MgH2的电子式为 .
②反应:SO2(g)+MgH2(s)+O2MgSO4(s)+H2(g)的△H=(用含△H1、△H2、△H3
的代数式表示).
(2)1300℃时,不同微粒的MgH2分解时放氢容量与时间的关系如图1所示. 
则粒径A,B,C从小到大的顺序是 .
(3)在2L的恒容密闭容器中加入1molMgO、1molSO2和0.5molO2 , 发生反应:2MgO(s)+2SO2(g)+O2(g)2MgSO4(s)△H3 , 测得SO2的平衡转化率与温度的关系如图2所示.
①该反应的△H3(填“>”或“<“,下同)0;Q点的反应速率:v(正)v(逆).
②P点对应温度下该反应的平衡常数为 .
③为提高SO2的转化率,除改变温度外,还可采取的措施有(任写2点).
(4)镁铝合金(Mg17Ar12)是一种贮氢合金,完全吸氢时生成氢化镁和金属铝,该吸氢反应的化学方程式为 . 7.32gMg17Ar12完全吸氢后所得的产物与足量稀H2SO4反应,释放出的氢气在标准状况下的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示: Fe2+ ![]() Fe3+
Fe3+ ![]() FeO42﹣(高铁酸根离子)
FeO42﹣(高铁酸根离子)
I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是nm.
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2 , 制造印刷电路板.写出FeCl3溶液腐蚀铜的化学反应方程式: . 检验反应后溶液中还存在Fe3+ 的试剂是 .
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O还原剂是 , 生成1molNa2FeO4转移电子数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).则关于有机物的说法正确的是( ) 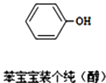
A.碳原子采用sp3杂化
B.氧原子采用sp2杂化
C.该有机物属于醇类
D.该分子中的13个原子有可能处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是NaOH、AlCl3、BaCl2、MgCl2四种物质中的一种,若将乙溶液滴入丁溶液中,发现有白色沉淀生成,继续滴加则沉淀消失;乙溶液滴入丙溶液中,无明显现象发生。据此可推断甲物质是
A.BaCl2B.NaOHC.AlCl3D.MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题: 
(1)该试剂中 H2SO4的物质的量浓度为molL﹣1 .
(2)某同学欲配制920mL物质的量浓度为0.30molL﹣1的稀硫酸,首先选择量程为mL的容量瓶,然后经理论计算需要量取mL上述浓硫酸(计算结果保留小数点后一位).
(3)下列各项实验操作或判断正确的是(填写字母).
A.配制0.1mol/L CuSO4溶液100mL,需称量CuSO45H2O 1.6g
B.在天平左右两盘中各放一张白纸后,可将NaOH固体放在右盘白纸上称量
C.用量筒可以精确量取25.03mL某种液体
D.需要235mL 0.9mol/L NaCl溶液,一般用250mL容量瓶进行配制
E.将配制好一定物质的量浓度的溶液,注入刚用水洗净的试剂瓶中,浓度不受影响.
(4)下列情况将使配制溶液的物质的量浓度偏低的有(填序号).
A.容量瓶用蒸馏水洗净后,未等内壁干燥便用来配制
B.烧碱在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
C.定容时,仰视刻度线
D.摇匀静置后,发现液面未到刻度线,继续补加水至刻度线
E.在溶解过程中有少量液体溅出烧杯外.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com