
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程为_________________________,工艺师常用____________(填物质名称)来雕刻玻璃,其所对应的方程式为___________
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,则Na2SiO3可作生产_______________的原料。
(3)工业上常用2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是____________(填化学式,下同),氧化剂是________________。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是____________(填化学式,下同),氧化剂是________________。
【答案】SiO2+2NaOH=Na2SiO3+H2O 氢氟酸 4HF+SiO2=SiF4↑+2H2O 防火剂 C SiO2
【解析】
(1)在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O;氢氟酸能与玻璃反应生成四氟化硅气体;
(2)水玻璃是矿物胶,不燃烧;
(3)在化学反应中元素化合价升高的反应物是还原剂,元素的化合价降低的反应物是氧化剂。
(1)NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O:SiO2+2NaOH=Na2SiO3+H2O,氢氟酸与玻璃发生的反应为:4HF+SiO2=SiF4↑+2H2O;
(2)水玻璃是矿物胶,不燃烧,而将硅酸钠浸泡棉花就阻隔了棉花与空气中氧气的直接接触,可用作防火剂的原料;
(3)碳元素化合价升高,硅元素化合价降低,二氧化硅是氧化剂。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】某溶液只含有K+、Fe2+、Cl-、Mg2+、I-、CO32-、SO42-中的几种,限用以下试剂检验:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象,下列叙述正确的是

A. 该溶液中一定有I-、CO32-、SO42-、K+
B. 溶液中可能含有K+、Mg2+、Cl-、
C. 通过在黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl-
D. 试剂②可能为硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳香烃是指两个或两个以上的苯环通过共用环边所构成的多环有机化合物。常见的稠环芳香烃如萘、蒽、菲、芘等,其结构分别为
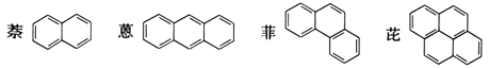
下列说法不正确的是( )
A. 萘与H2完全加成后,产物的分子式为C10H18
B. 蒽、菲、芘的一氯代物分别有3种、5种、5种
C. 上述四种物质的分子中,所有碳原子均共平面
D. 上述四种物质均能发生加成反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol/ L NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 反应的过程中产生的白色沉淀为CaCO3
C. 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
D. 加入CaCl2促进了HCO3-的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4KJ/mol
CO(g)+3H2(g) △H=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=______。
CO2(g)+4H2(g) △H=______。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如图。

①恒压时,反应一定达到平衡状态的标志是______(填序号):
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.![]() 的比值为3:2 D.
的比值为3:2 D.![]() =2
=2
②P1______P2(填“>”、“<”、“=”,下同):反应平衡常数:B点______D点;
③C点H2的转化率______;(数值保留0.1%)在A、B两点条件下,该反应从开始到平衡时生成氢气平均速率:v(A)______v(B)(填“>”、“<”、“=”)。
(3)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为______________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)=2HI(g)△H<0(用“加快”、“减慢”、“不变”填空)
(1)保持容器容积不变,向其中加入1molH2,反应速率_________
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率________
(3)保持容器内压强不变,向其中加入1molN2(N2不参加反应),反应速率______
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率______
(5)提高起始的反应温度,反应速率___________
(6)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0若起始时c(CO)=2molL-1,c(H2O)=3molL-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________(已知![]() )
)
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应 | 速率表达式 | 反应热 |
反应I:2NO(g) |
| △H1<0 |
反应II:N2O2(g)+O2(g) |
| △H2<0 |
反应2NO(g)+O2(g) ![]() 2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用
2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用![]() 、
、![]() 、
、![]() 、
、![]() 表示)
表示)
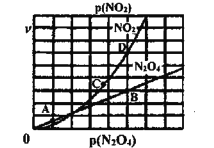
(3)反应N2O4(g) ![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中![]() 、
、![]() 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
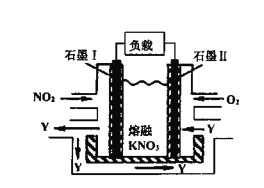
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的一类用于治疗急性缺血性脑卒中的新药即丁苯酞(N)的合成路线之一如下图所示(部分反应试剂及条件略去):

已知:R→Br![]()

请按要求回答下列问题:
(1)A的分子式:_________________;B→A的反应类型:_________________。
A分子中最多有_________________个原子共平面。
(2)D的名称:_________________;写出反应③的化学方程式:_________________________。
(3)N是含有五元环的芳香酯。写出反应⑦的化学方程式:_____________________。
(4)已知:E![]() X。X有多种同分异构体,写出满足下述所有条件的X的同分异构体的结构简式:________________________________________。
X。X有多种同分异构体,写出满足下述所有条件的X的同分异构体的结构简式:________________________________________。
①能发生银镜反应②能与氯化铁溶液发生显色反应③分子中有5种不同环境的氢原子
(5)写出以甲烷和上图芳香烃D为原料,合成有机物Y:![]() 的路线流程图(方框内填写中间产物的结构简式,箭头上注明试剂和反应条件):______________________________
的路线流程图(方框内填写中间产物的结构简式,箭头上注明试剂和反应条件):______________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ag 硝酸钾溶于bg水,形成VmL饱和溶液。下列关系式错误的是( )
A. 该溶液的物质的量浓度:c(KNO3)=![]() mol·L-1
mol·L-1
B. 该溶液的质量分数:w(KNO3)=![]() %
%
C. 20 ℃时KNO3的溶解度S=![]() g
g
D. 该溶液的密度ρ=![]() g·L-1
g·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com