
【题目】我国自主研发的一类用于治疗急性缺血性脑卒中的新药即丁苯酞(N)的合成路线之一如下图所示(部分反应试剂及条件略去):

已知:R→Br![]()

请按要求回答下列问题:
(1)A的分子式:_________________;B→A的反应类型:_________________。
A分子中最多有_________________个原子共平面。
(2)D的名称:_________________;写出反应③的化学方程式:_________________________。
(3)N是含有五元环的芳香酯。写出反应⑦的化学方程式:_____________________。
(4)已知:E![]() X。X有多种同分异构体,写出满足下述所有条件的X的同分异构体的结构简式:________________________________________。
X。X有多种同分异构体,写出满足下述所有条件的X的同分异构体的结构简式:________________________________________。
①能发生银镜反应②能与氯化铁溶液发生显色反应③分子中有5种不同环境的氢原子
(5)写出以甲烷和上图芳香烃D为原料,合成有机物Y:![]() 的路线流程图(方框内填写中间产物的结构简式,箭头上注明试剂和反应条件):______________________________
的路线流程图(方框内填写中间产物的结构简式,箭头上注明试剂和反应条件):______________________________

【答案】C4H8 消去反应 8 甲苯 ![]()
![]()
![]() +HBr
+HBr 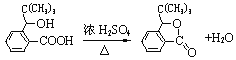
![]()
![]()
![]()
![]()
![]()
![]()
![]() CH3Br
CH3Br![]() CH3MgBr
CH3MgBr
【解析】
比较A、B的分子式可知,A与HBr发生加成反应生成B,摩尔质量为137g/mol,根据已知条件B转化为C(C4H9MgBr),结合A的摩尔质量为56g/mol,可知A为![]() ,比较D、E的分子式可知,D与液溴加入铁粉时发生取代反应生成E,E中甲基被氧化成醛基,根据G的结构可推知F中溴原子和醛基在邻位,则D为甲苯,E为
,比较D、E的分子式可知,D与液溴加入铁粉时发生取代反应生成E,E中甲基被氧化成醛基,根据G的结构可推知F中溴原子和醛基在邻位,则D为甲苯,E为![]() ,F为
,F为![]() ,再根据已知条件的反应,结合G的结构可知:C为
,再根据已知条件的反应,结合G的结构可知:C为 ,B为
,B为![]() ,A为
,A为![]() ,再根据反应可知,M为
,再根据反应可知,M为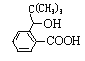 ,据此分析作答。
,据此分析作答。
(1)A的结构简式为![]() ,所以其分子式为:C4H8,
,所以其分子式为:C4H8, ![]() 生成
生成![]() ,其化学方程式可表示为:C(CH3)3Br + NaOH
,其化学方程式可表示为:C(CH3)3Br + NaOH![]()
![]() ↑+ NaBr + H2O,故反应类型为消去反应;根据乙烯分子中六个原子在同一平面上,假如两个甲基上各有一个氢原子在这个面上,则
↑+ NaBr + H2O,故反应类型为消去反应;根据乙烯分子中六个原子在同一平面上,假如两个甲基上各有一个氢原子在这个面上,则![]() 分子中最多有8个原子共平面;
分子中最多有8个原子共平面;
故答案为:C4H8;消去反应;8;
(2)D为甲苯,加入液溴和溴化铁(或铁),可发生取代反应生成![]() ,其化学方程式为:
,其化学方程式为:![]()
![]()
![]() +HBr,
+HBr,
故答案为:甲苯;![]()
![]()
![]() +HBr;
+HBr;
(3)N是含有五元环的芳香酯,则N是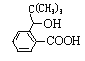 发生分子内的酯化反应生成的一种酯,反应的化学方程式为:
发生分子内的酯化反应生成的一种酯,反应的化学方程式为: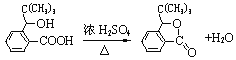 ,
,
故答案为: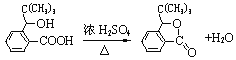 ;
;
(4)![]() ,则:
,则: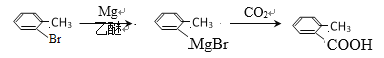 ,X为:
,X为:![]() ,X的同分异构体中,能与氯化铁溶液发生显色反应,说明分子中含有酚羟基,除了酚羟基,只剩下一个氧原子,且要能发生银镜反应,则应该还含有一个醛基。分子中有5种不同环境的氢原子的结构简式:
,X的同分异构体中,能与氯化铁溶液发生显色反应,说明分子中含有酚羟基,除了酚羟基,只剩下一个氧原子,且要能发生银镜反应,则应该还含有一个醛基。分子中有5种不同环境的氢原子的结构简式:![]() ,
,
故答案为:![]() ;
;
(7)以甲烷和甲苯为原料合成 ![]() 的路线为甲苯在光照条件下生成一卤代烃,在氢氧化钠的水溶液中加热水解产生的醇被氧化成醛,而另一方面甲烷也光照生成一卤代烃,在镁和乙醚的作用下生成的产物与醛反应得到终极产物,其合成路线为:
的路线为甲苯在光照条件下生成一卤代烃,在氢氧化钠的水溶液中加热水解产生的醇被氧化成醛,而另一方面甲烷也光照生成一卤代烃,在镁和乙醚的作用下生成的产物与醛反应得到终极产物,其合成路线为:![]()
![]()
![]()
![]()
![]()
![]() CH3Br
CH3Br![]() CH3MgBr,
CH3MgBr,
故答案为:![]()
![]()
![]()
![]()
![]()
![]() CH3Br
CH3Br![]() CH3MgBr。
CH3MgBr。


科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A. ![]() v(NH3)=v(O2) B.
v(NH3)=v(O2) B. ![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C. ![]() v(NH3)=v(H2O) D.
v(NH3)=v(H2O) D. ![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程为_________________________,工艺师常用____________(填物质名称)来雕刻玻璃,其所对应的方程式为___________
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,则Na2SiO3可作生产_______________的原料。
(3)工业上常用2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是____________(填化学式,下同),氧化剂是________________。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是____________(填化学式,下同),氧化剂是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是( )
A. NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B. 漂白粉溶液呈碱性的原因:ClO-+H2O![]() HClO+OH-
HClO+OH-
C. 酸性条件下用H2O2将海带灰中I-氧化:H2O2+2I-+2H+=I2+2H2O
D. 氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B![]() C(ΔH < 0)分两步进行:①A+B
C(ΔH < 0)分两步进行:①A+B![]() X(ΔH>0); ②X
X(ΔH>0); ②X![]() C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )。
C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )。
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。

(1)该反应的热化学方程式为_________________________________。
(2)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。A的仪器名称为____________________。
(3)如图所示,泡沫塑料板上面有两个小孔,两个小孔不能开得过大,其原因是__________;反应需要测量温度,每次测量温度后都必须采取的操作是_______________。
(4)某学生实验记录数据如下:
实验序号 | 起始温度T1 ℃ | 终止温度T2 ℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
已知盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃),依据该学生的实验数据计算,该实验测得的中和热ΔH=________ ;
(5)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),所求中和热_______(填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中的某些元素性质的有关数据

下列有关叙述正确的是
A. 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧
B. 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4
C. 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族
D. 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应3B(g) ![]() C(g)+D(g)的说法不正确的是( )
C(g)+D(g)的说法不正确的是( )
A.某时刻测得v正(B)=v逆(B),说明反应达到了化学平衡状态
B.反应达到化学平衡后,反应物和生成物的浓度不再改变
C.反应达到平衡后,反应就停止了
D.上述反应中,B不可能全部转化为C和D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)与氮同一主族,As原子比N原子多两个电子层。可以形成As2S3、As2O5、H3AsO3、H3AsO4,等化合物,有着广泛的用途。回答下列问题:
(1)As的原子序数为______________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式____________。该反应需要在加压下进行,原因是___________。
(3)己知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)
H2(g)+2O2(g)=H3AsO4(s) ![]()
H2(g)+![]() O2(g)=H2O(l)
O2(g)=H2O(l) ![]()
2As(s)+![]() O2(g)=As2O5(s)
O2(g)=As2O5(s) ![]()
则反应As2O5(s)+3 H2O(l)=2 H3AsO4(s)的![]() =______________________。
=______________________。
(4)298K肘,将2OmL 3xmol·L-1 Na3AsO3、20m L3xmol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是_____(填标号)。
a.v(I-)=2v(AsO33-) b.溶液的pH不再变化
c.c(I-)=ymol·L-1 d.c(AsO43-)/c(AsO33-)不再变化
②tm时,v正____v逆(填“大于”、“小于”或“等于”)。
③) tm时v逆____tn时v逆(填“大于”、“小于”或“等于”),理由是___________。
④若平衡时溶液的pH=14,则该反应的平衡常数为_____(用x、y表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com