
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A. ![]() v(NH3)=v(O2) B.
v(NH3)=v(O2) B. ![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C. ![]() v(NH3)=v(H2O) D.
v(NH3)=v(H2O) D. ![]() v(O2)=v(NO)
v(O2)=v(NO)
科目:高中化学 来源: 题型:
【题目】已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图![]() 下列说法正确的是
下列说法正确的是

A. a点溶液的pH=4
B. b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-)
C. b点c(HA)/c(A-)=5
D. c点c(A-)+c(H+)=c(Na+)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含有K+、Fe2+、Cl-、Mg2+、I-、CO32-、SO42-中的几种,限用以下试剂检验:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象,下列叙述正确的是

A. 该溶液中一定有I-、CO32-、SO42-、K+
B. 溶液中可能含有K+、Mg2+、Cl-、
C. 通过在黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl-
D. 试剂②可能为硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物![]() (W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下:
(W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下:

已知:
i.R1CHO+R2CH2CHO ![]()
![]()
ii.![]()
iii.R1CH=CHR2+R3CH=CHR4![]() R1CH=CHR4+R2CH=CHR3
R1CH=CHR4+R2CH=CHR3
(R代表烃基或氢原子)
(1)E所含的官能团名称是_____。
(2)N的名称是_____。
(3)②的反应类型是_____。
(4)①的化学方程式是_____。③的化学方程式是_____。
(5)X的结构简式是_____。
(6)Q有多种同分异构体,其中符合下列条件的有_____种。
①属于芳香类化合物且苯环上只有两个侧链
②遇FeCl3溶液显紫色
③苯环上的一氯代物只有两种
其中符合核磁共振氢谱中峰面积之比1:2:2:1:6的结构简式为_____(写出其中一种即可)。
(7)请以CH3CH2OH为原料(无机试剂任选),用不超过4步的反应合成CH3CH2CH2COOH,试写出合成流程图__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___;
(2)A与B的平衡转化率之比为___;
(3)反应过程中容器内气体的平均相对分子质量变化是___(填“增大”、“减小”或“不变”,下同),气体的密度变化是___;
(4)一定能说明上述反应已经达到化学平衡状态的是___。
a.容器内气体压强不再改变
b.2v(A)=3v(C)
c.A的浓度不再改变
d.A、B、C、D的分子数之比为3∶1∶2∶2
e.反应停止,不再继续进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像符合题意的是
A. 在盐酸和氯化铝的混合溶液中滴加烧碱溶液
B. 在碳酸钠与碳酸氢钠混合液中滴加盐酸
C. 在氢氧化钠溶液中通入氯气
D. 在氢氧化钡溶液中滴加碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳香烃是指两个或两个以上的苯环通过共用环边所构成的多环有机化合物。常见的稠环芳香烃如萘、蒽、菲、芘等,其结构分别为
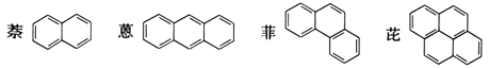
下列说法不正确的是( )
A. 萘与H2完全加成后,产物的分子式为C10H18
B. 蒽、菲、芘的一氯代物分别有3种、5种、5种
C. 上述四种物质的分子中,所有碳原子均共平面
D. 上述四种物质均能发生加成反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol/ L NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 反应的过程中产生的白色沉淀为CaCO3
C. 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
D. 加入CaCl2促进了HCO3-的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的一类用于治疗急性缺血性脑卒中的新药即丁苯酞(N)的合成路线之一如下图所示(部分反应试剂及条件略去):

已知:R→Br![]()

请按要求回答下列问题:
(1)A的分子式:_________________;B→A的反应类型:_________________。
A分子中最多有_________________个原子共平面。
(2)D的名称:_________________;写出反应③的化学方程式:_________________________。
(3)N是含有五元环的芳香酯。写出反应⑦的化学方程式:_____________________。
(4)已知:E![]() X。X有多种同分异构体,写出满足下述所有条件的X的同分异构体的结构简式:________________________________________。
X。X有多种同分异构体,写出满足下述所有条件的X的同分异构体的结构简式:________________________________________。
①能发生银镜反应②能与氯化铁溶液发生显色反应③分子中有5种不同环境的氢原子
(5)写出以甲烷和上图芳香烃D为原料,合成有机物Y:![]() 的路线流程图(方框内填写中间产物的结构简式,箭头上注明试剂和反应条件):______________________________
的路线流程图(方框内填写中间产物的结构简式,箭头上注明试剂和反应条件):______________________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com