
【题目】某溶液只含有K+、Fe2+、Cl-、Mg2+、I-、CO32-、SO42-中的几种,限用以下试剂检验:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象,下列叙述正确的是

A. 该溶液中一定有I-、CO32-、SO42-、K+
B. 溶液中可能含有K+、Mg2+、Cl-、
C. 通过在黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl-
D. 试剂②可能为硫酸
【答案】A
【解析】
由实验可知,试剂①为硝酸钡溶液,生成白色沉淀为碳酸钡和硫酸钡,则试剂②为盐酸,沉淀减少,硫酸钡不溶于盐酸,则原溶液中一定存在CO32-、SO42-,则不含Fe2+、Mg2+;加试剂①过滤后的滤液中,再加试剂②盐酸,H+、I-、NO3-发生氧化还原反应生成I2,溶液变黄色,由于溶液呈电中性,则溶液中一定含有的阳离子为K+。由上述分析可知,该溶液中一定有I-、CO32-、SO42-、K+,选项A正确;B、溶液中一定不含有Mg2+,选项B错误;C、加入足量盐酸会引入Cl-,故无法判断原溶液中是否存在Cl-,选项C错误;D、试剂②一定为盐酸,不能为硫酸,因为碳酸钡与硫酸反应生成硫酸钡会使沉淀质量增加,不符合题意,选项D错误。答案选A。


科目:高中化学 来源: 题型:
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。
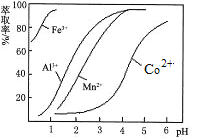
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是( )

A. 0~a间发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b间共消耗NaHSO3的物质的量为1.8mol
C. b~c间反应:I2仅是氧化产物
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以环氧乙烷和布洛芬为主要原料,按下列路线合成药物布洛芬酰甘氨酸钠。

己知:(1)RCOOH ![]() RCOC1
RCOC1 ![]() RCOORˊ
RCOORˊ
(2)R-Cl- ![]() R-NH2
R-NH2 ![]() R-NH2HC1
R-NH2HC1 ![]() RCONHR
RCONHR
请回答:
(1)写出化合物的结构简式:B_________ ; D_________ 。
(2)下列说法不正确的是_________。
A.![]() 转化为A为氧化反应
转化为A为氧化反应
B. RCOOH与SOCl2反应的产物有SO2和HC1
C.化合物B能发生缩聚反应
D.布洛芬酰甘氨酸钠的分子式为C15H19NO3Na
(3)写出同时符合下列条件的布洛芬的所有同分异构体_________。
①红外光谱表明分子中含有酯基,实验发现能与NaOH溶液1∶2反应,也能发生银镜反应;
②H—NMR谱显示分子中有三个相同甲基,且苯环上只有一种化学环境的氢原子。
(4)写出F→布洛芬酰甘氨酸钠的化学方程式_________。
(5)利用题给信息,设计以![]() 为原料制备(
为原料制备(![]() )的合成路线(用流程图表示:无机试剂任选)_____________________。
)的合成路线(用流程图表示:无机试剂任选)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。

(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为_______________,检验滤液A中存在该离子的试剂为___________(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_________________________,在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)为使固体混合物D在空气中灼烧完全分解,应_____________,直至连续两次测定的实验结果相同(或质量相差小于0.1 g)时为止;灼烧时必须用到的实验仪器是__________。
(4)溶液G与固体混合物B反应的离子方程式为__________________________。
(5)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的本质是旧化学键的断裂和新化学键的形成。已知某些化学键的键能数据如下:
化学键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 243 | 431 |
则下列热化学方程式不正确的是( )
A.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=-91.5kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ·mol-1
C.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=+91.5kJ·mol-1
Cl2(g)=HCl(g) ΔH=+91.5kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g) ΔH=+183kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A. ![]() v(NH3)=v(O2) B.
v(NH3)=v(O2) B. ![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C. ![]() v(NH3)=v(H2O) D.
v(NH3)=v(H2O) D. ![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程为_________________________,工艺师常用____________(填物质名称)来雕刻玻璃,其所对应的方程式为___________
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,则Na2SiO3可作生产_______________的原料。
(3)工业上常用2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是____________(填化学式,下同),氧化剂是________________。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是____________(填化学式,下同),氧化剂是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com