
����Ŀ���ۺ���![]() ��W�������еIJ��ֽṹ����һ����Ҫ�Ĺ��ܸ߷��Ӳ��ϣ��ۺ���X�����е�һ�֣�ת��·��������
��W�������еIJ��ֽṹ����һ����Ҫ�Ĺ��ܸ߷��Ӳ��ϣ��ۺ���X�����е�һ�֣�ת��·��������

��֪��
i��R1CHO+R2CH2CHO ![]()
![]()
ii��![]()
iii��R1CH=CHR2+R3CH=CHR4![]() R1CH=CHR4+R2CH=CHR3
R1CH=CHR4+R2CH=CHR3
��R������������ԭ�ӣ�
��1��E����������������_____��
��2��N��������_____��
��3���ڵķ�Ӧ������_____��
��4���ٵĻ�ѧ����ʽ��_____���۵Ļ�ѧ����ʽ��_____��
��5��X�Ľṹ��ʽ��_____��
��6��Q�ж���ͬ���칹�壬���з���������������_____����
�����ڷ���������ұ�����ֻ����������
����FeCl3��Һ����ɫ
�۱����ϵ�һ�ȴ���ֻ������
���з��Ϻ˴Ź��������з����֮��1��2��2��1��6�Ľṹ��ʽΪ_____��д������һ�ּ��ɣ���
��7������CH3CH2OHΪԭ�ϣ����Լ���ѡ�����ò�����4���ķ�Ӧ�ϳ�CH3CH2CH2COOH����д���ϳ�����ͼ__________��
���𰸡�̼̼˫����ȩ�� ��ϩ����� �ӳɷ�Ӧ CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O
CH2=CHCOOCH3+H2O  +2NaOH
+2NaOH![]()
![]() +2 NaBr+2 H2O
+2 NaBr+2 H2O  10
10 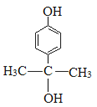 ��
�� CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH2CH=CHCHO
CH2CH=CHCHO![]() CH2CH=CHCOOH
CH2CH=CHCOOH![]() CH3CH2CH2COOH
CH3CH2CH2COOH
��������
��1��EΪCH2=CHCHO�����еĹ�����Ϊ̼̼˫����ȩ������2��NΪCH2=CHCOOCH3��Ϊ��ϩ���������3��G��I�ṹ��ʽ�ֱ�Ϊ![]() ��
�� ���ɴ˿�֪�ڵķ�Ӧ�����Ǽӳɷ�Ӧ����4���ٷ�������������Ӧ����Ӧ�Ļ�ѧ����ʽ�ǣ�CH2=CHCOOH+CH3OH
���ɴ˿�֪�ڵķ�Ӧ�����Ǽӳɷ�Ӧ����4���ٷ�������������Ӧ����Ӧ�Ļ�ѧ����ʽ�ǣ�CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O���۷�������±��������ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽ�ǣ�
CH2=CHCOOCH3+H2O���۷�������±��������ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽ�ǣ� +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O����5������Ϣiii��֪
+2NaBr+2H2O����5������Ϣiii��֪![]() ��Ro�������������ɾۺ���XΪ
��Ro�������������ɾۺ���XΪ ����6��Q�ķ���ʽΪC9H12O2�������Ͷ���=(2��9+2��12)/2��4�����Ӧ��ͬ���칹���У������ڷ���������ұ�����ֻ�����������������Ϊ���Ͳ���������FeCl3��Һ����ɫ��˵�����з��ǻ����۱����ϵ�һ�ȴ���ֻ�����֣�˵����һ��������ǻ���λ����Ϊ��OCH(CH3)2����OCH2CH2CH3����CH2OCH2CH3����CH(CH3)OCH3����CH2CH2OCH3����CH2CH2CH2OH
����6��Q�ķ���ʽΪC9H12O2�������Ͷ���=(2��9+2��12)/2��4�����Ӧ��ͬ���칹���У������ڷ���������ұ�����ֻ�����������������Ϊ���Ͳ���������FeCl3��Һ����ɫ��˵�����з��ǻ����۱����ϵ�һ�ȴ���ֻ�����֣�˵����һ��������ǻ���λ����Ϊ��OCH(CH3)2����OCH2CH2CH3����CH2OCH2CH3����CH(CH3)OCH3����CH2CH2OCH3����CH2CH2CH2OH ��
�� ����7����CH3CH2OHΪԭ�ϣ��ϳ�CH3CH2CH2COOH��������֪��Ϣ�����������Ʒ���֪������Ӧ������ΪCH3CH2OH
����7����CH3CH2OHΪԭ�ϣ��ϳ�CH3CH2CH2COOH��������֪��Ϣ�����������Ʒ���֪������Ӧ������ΪCH3CH2OH![]() CH3CHO
CH3CHO![]() CH2CH=CHCHO
CH2CH=CHCHO![]() CH2CH=CHCOOH
CH2CH=CHCOOH![]() CH3CH2CH2COOH��
CH3CH2CH2COOH��


 �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д������ʽ��
��1������ϡ���ᣨд�����ӷ���ʽ��___��
��2������������Һ��ϡ���ᣨд�����ӷ���ʽ��__��
��3������ͭ��ϡ���ᣨд�����ӷ���ʽ��__��
��4���Ʊ������������壨д����Ӧ�Ļ�ѧ����ʽ��___��
��5��CO32-+2H+=CO2��+H2O��д����Ӧ�Ļ�ѧ����ʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ԭ��HSO3->I-��������IO3->I2���ں�3 mol NaHSO3����Һ����μ���KIO3��Һ������KIO3������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ������˵������ȷ���ǣ� ��

A. 0~a�䷢����Ӧ��3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b�乲����NaHSO3�����ʵ���Ϊ1.8mol
C. b~c�䷴Ӧ��I2������������
D. ����Һ��I-��I2�����ʵ���֮��Ϊ5��3ʱ�������KIO3Ϊ1.08mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͭ��ʯ����Ҫ�ɷ���Cu2O��������������Al2O3��Fe2O3��SiO2��ij�������ô˿�ʯ���ƾ�ͭ�Ĺ���������ͼ��ʾ(��֪��Cu2O��2H��===Cu��Cu2����H2O)��

(1)��ҺA����Ԫ�صĴ�����ʽΪ______________(�����ӷ���)�����ɸ����ӵ����ӷ���ʽΪ_______________��������ҺA�д��ڸ����ӵ��Լ�Ϊ___________(���Լ�����)��
(2)����E�����F������ijһ��Ӧ�����ں��Ӹֹ죬�÷�Ӧ�Ļ�ѧ����ʽΪ_________________________����ʵ��������ɴ�ʵ�黹��Ҫ���Լ���________��
a��KClO3 b��KCl c��Mg d��MnO2
(3)Ϊʹ��������D�ڿ�����������ȫ�ֽ⣬Ӧ_____________��ֱ���������βⶨ��ʵ������ͬ(���������С��0.1 g)ʱΪֹ������ʱ�����õ���ʵ��������__________��
(4)��ҺG���������B��Ӧ�����ӷ���ʽΪ__________________________��
(5)��Na2CO3��Һ���뵽һ������CuCl2��Һ�У��õ��Ȼ��ơ�������̼��һ����ɫ�IJ�����ˮ����(�����ᾧˮ)���������ȷֽ�����������������εĻ�ѧʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�ı����Ǿɻ�ѧ���Ķ��Ѻ��»�ѧ�����γɡ���֪ijЩ��ѧ���ļ����������£�
��ѧ�� | H��H | Cl��Cl | H��Cl |
����/(kJ��mol-1) | 436 | 243 | 431 |
�������Ȼ�ѧ����ʽ����ȷ���ǣ� ��
A.![]() H2(g)��
H2(g)��![]() Cl2(g)=HCl(g) ��H=-91.5kJ��mol-1
Cl2(g)=HCl(g) ��H=-91.5kJ��mol-1
B.H2(g)��Cl2(g)=2HCl(g) ��H=-183kJ��mol-1
C.![]() H2(g)��
H2(g)��![]() Cl2(g)=HCl(g) ��H=+91.5kJ��mol-1
Cl2(g)=HCl(g) ��H=+91.5kJ��mol-1
D.2HCl(g)=H2(g)��Cl2(g) ��H=+183kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuCl����ʰ�ɫ���۵�Ϊ430�����е�Ϊ1490��������ֽ⣬¶���ڳ�ʪ�������ױ�������������ˮ��ϡ���ᡢ�Ҵ���������Ũ��������H3CuCl4����Ӧ�Ļ�ѧ����ʽΪCuCl��s��+3HCl��aq��H3CuCl4��aq����
��1��ʵ��������ͼ1��ʾװ����ȡCuCl����Ӧԭ��Ϊ��
2Cu2++SO2+8Cl��+2H2O�T2CuCl43��+SO![]() +4H+
+4H+
CuCl43����aq��CuCl��s��+3Cl����aq��

��װ��C��������_____��
��װ��B�з�Ӧ������ȡ������������ͼ��ʾ�������õ�CuCl���壮
�����![]()
![]()
![]()
![]()
![]() CuCl����
CuCl����
����������ҪĿ����_____
�����������ѡ�õ��Լ���_____��
��ʵ���ұ�������CuCl����ķ�����_____��
�����ᴿij����ͭ�۵�CuCl���壬�����ʵ�鷽����_____��
��2��ijͬѧ������ͼ2��ʾװ�ã��ⶨ��¯ú����CO��CO2��N2��O2�İٷ���ɣ�
��֪��
i��CuCl��������Һ������CO�γ�Cu��CO��ClH2O��
ii�����շۣ�Na2S2O4����KOH�Ļ����Һ������������
��D��Fϴ��ƿ����ʢ�ŵ��Լ��ֱ���_____��_____��
��д�����շۺ�KOH�Ļ����Һ����O2�����ӷ���ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��4NH3+5O2=4NO+6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ������ȷ�Ĺ�ϵ��( )
A. ![]() v(NH3)=v(O2) B.
v(NH3)=v(O2) B. ![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C. ![]() v(NH3)=v(H2O) D.
v(NH3)=v(H2O) D. ![]() v(O2)=v(NO)
v(O2)=v(NO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���ھ�����ˮ��ͬʱ�ܻ����Դ��õ��м�ֵ�Ļ�ѧ��Ʒ������ͼΪ�乤��ԭ��������ͼΪ��ˮ��Cr2O72-����Ũ����ȥ���ʵĹ�ϵ������˵������ȷ������ ��


A. ������Ӧʽ��O2��4H����4e��=2H2O��Cr2O72����14H����6e��=2Cr3����7H2O
B. ��ع���ʱ��N��������ҺpH����
C. ����1molCr2O72-ʱ��6molH+�ӽ���Ĥ������Ҳ�Ǩ��
D. Cr2O72-����Ũ�Ƚϴ�ʱ�����ܻ���ɻ�ԭ��ʧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ����ȷ����( )
A. NO2����ˮ��3NO2+H2O=2H++2NO3-+NO
B. Ư����Һ�ʼ��Ե�ԭ��ClO-+H2O![]() HClO+OH-
HClO+OH-
C. ������������H2O2����������I-������H2O2+2I-+2H+=I2+2H2O
D. �Ȼ�����Һ�м�������İ�ˮ��Al3++4NH3��H2O=AlO2-+4NH4++2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com