
【题目】下列指定反应的离子方程式不正确的是( )
A. NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B. 漂白粉溶液呈碱性的原因:ClO-+H2O![]() HClO+OH-
HClO+OH-
C. 酸性条件下用H2O2将海带灰中I-氧化:H2O2+2I-+2H+=I2+2H2O
D. 氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】聚合物![]() (W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下:
(W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下:

已知:
i.R1CHO+R2CH2CHO ![]()
![]()
ii.![]()
iii.R1CH=CHR2+R3CH=CHR4![]() R1CH=CHR4+R2CH=CHR3
R1CH=CHR4+R2CH=CHR3
(R代表烃基或氢原子)
(1)E所含的官能团名称是_____。
(2)N的名称是_____。
(3)②的反应类型是_____。
(4)①的化学方程式是_____。③的化学方程式是_____。
(5)X的结构简式是_____。
(6)Q有多种同分异构体,其中符合下列条件的有_____种。
①属于芳香类化合物且苯环上只有两个侧链
②遇FeCl3溶液显紫色
③苯环上的一氯代物只有两种
其中符合核磁共振氢谱中峰面积之比1:2:2:1:6的结构简式为_____(写出其中一种即可)。
(7)请以CH3CH2OH为原料(无机试剂任选),用不超过4步的反应合成CH3CH2CH2COOH,试写出合成流程图__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol/ L NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 反应的过程中产生的白色沉淀为CaCO3
C. 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
D. 加入CaCl2促进了HCO3-的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)=2HI(g)△H<0(用“加快”、“减慢”、“不变”填空)
(1)保持容器容积不变,向其中加入1molH2,反应速率_________
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率________
(3)保持容器内压强不变,向其中加入1molN2(N2不参加反应),反应速率______
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率______
(5)提高起始的反应温度,反应速率___________
(6)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0若起始时c(CO)=2molL-1,c(H2O)=3molL-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________(已知![]() )
)
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应 | 速率表达式 | 反应热 |
反应I:2NO(g) |
| △H1<0 |
反应II:N2O2(g)+O2(g) |
| △H2<0 |
反应2NO(g)+O2(g) ![]() 2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用
2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用![]() 、
、![]() 、
、![]() 、
、![]() 表示)
表示)
(3)反应N2O4(g) ![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中![]() 、
、![]() 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
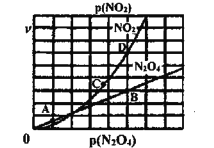
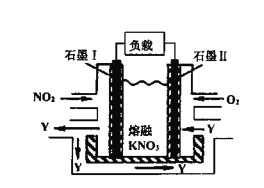
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】导电仪测得液态BrF3具有微弱的导电性,表示BrF3(液)中有阴、阳离子X和Y。X和Y也存在于BrF2SbF6、KBrF4、(BrF2)2SnF6等化合物中,则X、Y的化学式分别为( )
A. X=F-;Y=Br3+ B. X=F-;Y=BrF2+ C. X=BrF4-;Y=BrF2+ D. X=BrF4-;Y=Br3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的一类用于治疗急性缺血性脑卒中的新药即丁苯酞(N)的合成路线之一如下图所示(部分反应试剂及条件略去):

已知:R→Br![]()

请按要求回答下列问题:
(1)A的分子式:_________________;B→A的反应类型:_________________。
A分子中最多有_________________个原子共平面。
(2)D的名称:_________________;写出反应③的化学方程式:_________________________。
(3)N是含有五元环的芳香酯。写出反应⑦的化学方程式:_____________________。
(4)已知:E![]() X。X有多种同分异构体,写出满足下述所有条件的X的同分异构体的结构简式:________________________________________。
X。X有多种同分异构体,写出满足下述所有条件的X的同分异构体的结构简式:________________________________________。
①能发生银镜反应②能与氯化铁溶液发生显色反应③分子中有5种不同环境的氢原子
(5)写出以甲烷和上图芳香烃D为原料,合成有机物Y:![]() 的路线流程图(方框内填写中间产物的结构简式,箭头上注明试剂和反应条件):______________________________
的路线流程图(方框内填写中间产物的结构简式,箭头上注明试剂和反应条件):______________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)ClO2的制备及性质探究(如图所示)。

①仪器a的名称为________,装置B的作用是________。
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_________。装置D中滴有几滴淀粉溶液,其作用是________________。
③装置E用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为________,氧化产物是___________。
(2)粗略测定生成ClO2的量
实验步骤如下:
a. 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤D瓶2~3次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b. 从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去24.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是_____________。
②进入装置D中的ClO2质量为_______,与C中ClO2的理论产量相比,测定值偏低,可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,33.6 L氧气的物质的量为________mol;标准状况下,2 mol氢气的体积为________L。
(2)标准状况下,6 g氢气的体积为________L;标准状况下,体积为11.2 L的CO2的质量为________g。
(3)标准状况下,11.2 L氯气的分子数目是________;标准状况下,1.204×1023个氧气分子的体积是________L。
(4)标准状况下,某气体的密度为1.25 g·L-1,则其摩尔质量为________g·mol-1。
(5)实验室用H2O2和MnO2制备O2,2H2O2![]() 2H2O+O2↑,现有34 g H2O2,可制得O2在标准状况下的体积是__________。
2H2O+O2↑,现有34 g H2O2,可制得O2在标准状况下的体积是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com