
【题目】导电仪测得液态BrF3具有微弱的导电性,表示BrF3(液)中有阴、阳离子X和Y。X和Y也存在于BrF2SbF6、KBrF4、(BrF2)2SnF6等化合物中,则X、Y的化学式分别为( )
A. X=F-;Y=Br3+ B. X=F-;Y=BrF2+ C. X=BrF4-;Y=BrF2+ D. X=BrF4-;Y=Br3+
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO![]() +4H+
+4H+
CuCl43﹣(aq)CuCl(s)+3Cl﹣(aq)

①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物![]()
![]()
![]()
![]()
![]() CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)ClH2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某小组对岩脑砂进行以下探究。
Ⅰ.岩脑砂的实验室制备

(1)C装置中盛放碱石灰的仪器名称为____________________。
(2)为使氨气和氯气在D中充分混合并反应,上述装置的连接顺序为a→d→c→____、_____←j←i←h←g←b。
(3)装置D处除易堵塞导管外,还有不足之处为______________________。
(4)检验氨气和氯气反应有岩脑砂生成时,除了蒸馏水、稀HNO3、AgNO3溶液、红色石蕊试纸外,还需要的试剂为_______________________。
Ⅱ.天然岩脑砂中NH4Cl纯度的测定(杂质不影响NH4Cl纯度测定)
已知:2NH4Cl+3CuO![]() 3Cu+2HCl↑+N2↑+3H2O。
3Cu+2HCl↑+N2↑+3H2O。
步骤:①准确称取1.19g岩脑砂;②将岩脑砂与足量的氧化铜混合加热(装置如下)。

(1)连接好仪器后,检查装置的气密性时,先将H和K中装入蒸馏水,然后加热G,____,则气密性良好。
(2)装置H的作用___________________________。
(3)实验结束后,装置I增重0.73g,则天然岩脑砂中NH4Cl的质量分数为_________________。
(4)若用K中气体体积测定NH4Cl纯度,当量气管内液面低于量筒内液面时,所测纯度______(填“偏高”、“ 无影响”或“偏低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),下列有关Ts的说法不正确的是( )
”,tián),下列有关Ts的说法不正确的是( )
A. Ts的电子所在最高能层符号是Q B. Ts的原子有一个未配对电子
C. Ts的电负性在同周期主族元素中最大 D. Ts原子有7种能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是( )
A. NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B. 漂白粉溶液呈碱性的原因:ClO-+H2O![]() HClO+OH-
HClO+OH-
C. 酸性条件下用H2O2将海带灰中I-氧化:H2O2+2I-+2H+=I2+2H2O
D. 氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究K2Cr2O7中Cr在不同条件下存在的主要形式及性质特点。室温下(除系列实验I中ii外)进行了如下系列实验:
系列实验I | 装置 | 滴管中的试剂 | 试管中的试剂 | 操作 | 现象 |
i |
| 1 mL水 | 4mL 0.1 mol·L-1 K 2Cr2O7 橙色溶液 | 振荡 | 溶液颜色略微变浅 |
ii | 1 mL水 | 振荡 60℃水浴 | 溶液颜色较i明显变浅 | ||
iii | 1 mL 18.4 mol·L-1 浓硫酸 | 振荡 | 溶液颜色较i明显变深 | ||
iv | 1 mL 6 mol·L-1 NaOH 溶液 | 振荡 | _____________________ | ||
v | 3滴浓KI溶液 | iv中溶液 | 振荡 | 无明显现象 | |
vi | 过量稀硫酸 | v中溶液 | 边滴边振荡 | 溶液颜色由黄色逐渐变橙色,最后呈墨绿色 |
已知:K2CrO4溶液为黄色;Cr3+在水溶液中为绿色。
请按要求回答下列问题:
(1)写出K2C2O7在酸性条件下平衡转化的离子方程式:________________________。对比实验i与ii,可得结论是该转化反应的△H______0(填>”或“<”)。
(2)结合实验i、ii,分析导致ii中现象出现的主要因素是__________________。
(3)推测实验iv中实验现象为________________________。对比实验i、ii、iv中实验现象,可知,常温下K2Cr2O7中Cr在碱性条件下主要以______离子形式存在。
(4)对比实验v与vi,可知:在______条件下,+6价Cr被还原为______。
(5)应用上述实验结论,进一步探究含Cr2O72-废水样品用电解法处理效果的影响因素,实验结果如下表所示(Cr2O72-的起始浓度、体积,电压、电解时间等均相同)。
系列实验Ⅱ | i | ii | iii | iv |
样品中是否加Fe2(SO4)3 | 否 | 否 | 加入5 g | 否 |
样品中是否加入稀硫酸 | 否 | 加入1 mL | 加入1 mL | 加入1 mL |
电极材料 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 | ||
Cr2O72- | 0.922 | 12.7 | 20.8 | 57.3 |
①实验中Cr2O72-在阴极的反应式:_________________________________________________。

②实验i中Fe3+去除Cr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。

(1)该反应的热化学方程式为_________________________________。
(2)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。A的仪器名称为____________________。
(3)如图所示,泡沫塑料板上面有两个小孔,两个小孔不能开得过大,其原因是__________;反应需要测量温度,每次测量温度后都必须采取的操作是_______________。
(4)某学生实验记录数据如下:
实验序号 | 起始温度T1 ℃ | 终止温度T2 ℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
已知盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃),依据该学生的实验数据计算,该实验测得的中和热ΔH=________ ;
(5)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),所求中和热_______(填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B. 氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓
D. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述不正确的是
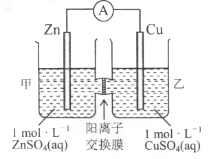
A. 锌电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,保持溶液中电荷平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com