
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),下列有关Ts的说法不正确的是( )
”,tián),下列有关Ts的说法不正确的是( )
A. Ts的电子所在最高能层符号是Q B. Ts的原子有一个未配对电子
C. Ts的电负性在同周期主族元素中最大 D. Ts原子有7种能量相同的电子
科目:高中化学 来源: 题型:
【题目】对可逆反应N2+3H2![]() 2NH3,用v(H2)和v(N2)分别表示其中的化合反应的速率,用v(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )
2NH3,用v(H2)和v(N2)分别表示其中的化合反应的速率,用v(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )
A.3v(N2)=v(H2)
B.v(H2)=v(NH3)
C.2v(H2)=3v(NH3)
D.v(N2)=3v(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为________。
(2)2-巯基烟酸( )水溶性优于2–巯基烟酸氧钒配合物(
)水溶性优于2–巯基烟酸氧钒配合物( )的原因是___________________________________________________________________。
)的原因是___________________________________________________________________。
(3)各原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)尿素(H2NCONH2)尿素分子中,原子杂化轨道类型有________,σ键与π键数目之比为________。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如左下图)和六方氮化硼(如右下图),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。左上图中原子坐标参数A为(0,0,0),D为(![]() ,
,![]() ,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(
,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(![]() =1.732)。
=1.732)。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表这式为________pm。(已知正六边形面积为![]() a2,a为边长)
a2,a为边长)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2 g铁粉与2.2 g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
A. 11.2 L B. 5.6 L C. 4.48 L D. 2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)=2HI(g)△H<0(用“加快”、“减慢”、“不变”填空)
(1)保持容器容积不变,向其中加入1molH2,反应速率_________
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率________
(3)保持容器内压强不变,向其中加入1molN2(N2不参加反应),反应速率______
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率______
(5)提高起始的反应温度,反应速率___________
(6)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0若起始时c(CO)=2molL-1,c(H2O)=3molL-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)为原料制备颜料铁红(Fe2O3)、晶体E,回收H和重金属混合物的生产工艺流程如下图所示:

请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为__________________。
Fe在周期表中的位置为第________周期第Ⅷ族。
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是________________________。过程①溶解烧渣所需试剂中溶质的化学式为__________________。
反应②的化学方程式:______________________________________________________。
(3)反应③的目的是____________________________________。
气体Z的电子式:__________________。
写出反应④的离子方程式:______________________________________________________。
(4)将回收的G溶于少量水,所得溶液中所有离子的浓度由大到小依次是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】导电仪测得液态BrF3具有微弱的导电性,表示BrF3(液)中有阴、阳离子X和Y。X和Y也存在于BrF2SbF6、KBrF4、(BrF2)2SnF6等化合物中,则X、Y的化学式分别为( )
A. X=F-;Y=Br3+ B. X=F-;Y=BrF2+ C. X=BrF4-;Y=BrF2+ D. X=BrF4-;Y=Br3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物分子中的碳碳双键发生臭氧氧化反应: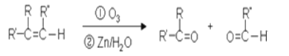 ,有机物A的结构简式为
,有机物A的结构简式为 ,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:

(1)下列说法正确的是 ______ 。(填字母序号)
A.C的官能团为羧基
B.1molA最多可以和2molNaOH反应
C.C可以发生氧化反应、取代反应和加成反应
D.![]() 可以发生消去反应
可以发生消去反应
(2)F的结构简式为____________ ,由F到G的反应类型为___________ 。
(3)反应①的作用是__________________ ,合适的试剂a为____________。
(4)同时满足下列条件的A的一种同分异构体的结构简式______________________。
Ⅰ.与A具有相同的官能团;Ⅱ.属于苯的邻二取代物;Ⅲ.能使FeCl3溶液显色;Ⅳ.核磁共振氢谱分析,分子中有8种不同化学环境的氢原子。
(5)H与G分子具有相同的碳原子数目,且1molH能与足量的新制银氨溶液反应生成4mol单质银。写出H与足量的新制银氨溶液反应的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com