
【题目】(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为________。
(2)2-巯基烟酸( )水溶性优于2–巯基烟酸氧钒配合物(
)水溶性优于2–巯基烟酸氧钒配合物( )的原因是___________________________________________________________________。
)的原因是___________________________________________________________________。
(3)各原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)尿素(H2NCONH2)尿素分子中,原子杂化轨道类型有________,σ键与π键数目之比为________。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如左下图)和六方氮化硼(如右下图),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。左上图中原子坐标参数A为(0,0,0),D为(![]() ,
,![]() ,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(
,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(![]() =1.732)。
=1.732)。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表这式为________pm。(已知正六边形面积为![]() a2,a为边长)
a2,a为边长)
【答案】![]() 2-巯基烟酸的羧基可与水分子之间形成氢鍵,使其在水中溶解度增大 AD sp2、sp3 7∶1 (
2-巯基烟酸的羧基可与水分子之间形成氢鍵,使其在水中溶解度增大 AD sp2、sp3 7∶1 (![]() ,
,![]() ,
,![]() ) 156.5
) 156.5 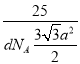 ×1010
×1010
【解析】
(1)考查轨道式的书写,Cu属于副族元素,价电子应是最外层电子和次外层d能级上的电子,因此Cu2+的价层电子的轨道式是![]() ;(2)考查溶解性,2-巯基烟酸的羧基可与水分子之间形成氢鍵,使其在水中溶解度增大;(3)考查化学键类型,A、SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,价层电子对数为3,则SO2空间构型为V型,符合题中所给条件,即存在离域π键,故A正确;B、SO42-中心原子S含有4个σ键,孤电子对数为(6+2-4×2)/2=0,价层电子对数为4,空间构型为正四面体,不符合题中信息,不含离域π键,故B错误;C、H2S的空间构型为V型,但H不含p能级,即不存在离域π键,故C错误;D、CS2空间构型为直线型,符合信息,存在离域π键,故D正确;(4)考查杂化类型的判断、化学键数目的判断,尿素的结构简式为
;(2)考查溶解性,2-巯基烟酸的羧基可与水分子之间形成氢鍵,使其在水中溶解度增大;(3)考查化学键类型,A、SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,价层电子对数为3,则SO2空间构型为V型,符合题中所给条件,即存在离域π键,故A正确;B、SO42-中心原子S含有4个σ键,孤电子对数为(6+2-4×2)/2=0,价层电子对数为4,空间构型为正四面体,不符合题中信息,不含离域π键,故B错误;C、H2S的空间构型为V型,但H不含p能级,即不存在离域π键,故C错误;D、CS2空间构型为直线型,符合信息,存在离域π键,故D正确;(4)考查杂化类型的判断、化学键数目的判断,尿素的结构简式为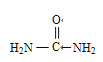 ,判断出N、C、O杂化类型分别是sp3、sp2、sp3;成键原子之间只能形成1个σ键,因此1mol尿素中含有σ键的物质的量为7mol,含有π键的物质的量为1mol,比值为7:1;(5)考查晶胞的计算,①BN结构类似于金刚石的结构,因此BN为原子晶体,根据金刚石晶胞结构贴点,E的坐标为(1/4,3/4,3/4);立方氮化硼中B和N最近的距离是体对角线的1/4,求出B与N之间的距离应是
,判断出N、C、O杂化类型分别是sp3、sp2、sp3;成键原子之间只能形成1个σ键,因此1mol尿素中含有σ键的物质的量为7mol,含有π键的物质的量为1mol,比值为7:1;(5)考查晶胞的计算,①BN结构类似于金刚石的结构,因此BN为原子晶体,根据金刚石晶胞结构贴点,E的坐标为(1/4,3/4,3/4);立方氮化硼中B和N最近的距离是体对角线的1/4,求出B与N之间的距离应是![]() pm(x为晶胞的边长),即为156.5pm;②根据六方氮化硼的结构,B的个数为6×1/6+3×1/3=2,晶胞的质量为
pm(x为晶胞的边长),即为156.5pm;②根据六方氮化硼的结构,B的个数为6×1/6+3×1/3=2,晶胞的质量为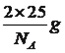 ,根据晶胞的体积为(
,根据晶胞的体积为(![]() a2×h)cm3(h为六方氮化硼的高),根据晶胞的密度的定义,求出h=2×
a2×h)cm3(h为六方氮化硼的高),根据晶胞的密度的定义,求出h=2×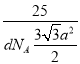 cm,层与层之间的距离应是高的一半,因此
cm,层与层之间的距离应是高的一半,因此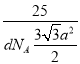 ×1010pm。
×1010pm。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】H、N、O、Na、S、Cl都是中学化学中的常见元素,根据题意回答与这些元素有关的问题:
(1)画出Na原子结构示意图_______,Na2O2可用作供氧剂,其电子式为_______。
(2)Cl2是一种大气污染物,装有液氯的钢瓶上应贴的标签是_______(填编号)。

氯气泄漏可用NaHSO3溶液来处理,写出相关的离子反应方程式_____________。
(3)25C时,利用pH试纸测得0.1mol/L氨水的pH约为11,则可以估算出氨水的电离常数约为_____;向10mL此溶液中通入少量氨气,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
(4)有两种化合物同时含有上述六元素中的四种元素。将这两种化合物的溶液混合后,恰好完全反应,生成物之一M仍含有这四种元素,该反应的离子方程式为______________。若M溶液的pH =5,则由水电离出的c(H+)=_______mol/L,该溶液离子浓度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO![]() +4H+
+4H+
CuCl43﹣(aq)CuCl(s)+3Cl﹣(aq)

①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物![]()
![]()
![]()
![]()
![]() CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)ClH2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废渣中含有Al 2O3和Cr2O3(三氧化二铬),再次回收利用工艺流程如下。

回答下列问题:
(1)滤液1中阴离子为CrO42-和AlO2-,X的电子式是_______。写出滤液1与过量气体X反应生成Al(OH) 3的离子方程式:_____________________。
(2)“熔烧”中反应之一是4Na2CO3+ 2Cr2O3+ 3O2 =4Na2CrO4+ 4X,该反应中被氧化的物质是______(填化学式);若该反应转移6mol电子,则生成_____mol Na2CrO4。
(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。写出离子方程式____________。
(4)已知该废料中含铬元素质量分数为a%,wt这样废料经上述流程提取mkgCr2O3。则该废料中铬元素回收率为_______(用代数式表示)。(已知回收率等于实际回收质量与理论质量之比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,左下图为其工作原理,右下图为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是( )


A. 正极反应式是O2+4H++4e-=2H2O,Cr2O72-+14H++6e-=2Cr3++7H2O
B. 电池工作时,N极附近溶液pH增大
C. 处理1molCr2O72-时有6molH+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用于通过测定单位时间内产生气体的体积来测量反应速率的装置,下列说法中正确的是( )

A. 如果在分液漏斗中加入稀硫酸,在锥形瓶中加入纯锌比加入粗锌产生氢气速率快
B. 如果在分液漏斗中加入浓硫酸,在锥形瓶中加入粗锌比加入纯锌产生氢气快
C. 在锥形瓶中加入纯锌,在分液漏斗中加入稀硫酸比加入稀硫酸和少量硫酸铜产生氢气速率快
D. 在锥形瓶中加入纯锌,在分液漏斗中加入稀硫酸和少量硫酸铜比加入稀硫酸产生氢气速率快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某小组对岩脑砂进行以下探究。
Ⅰ.岩脑砂的实验室制备

(1)C装置中盛放碱石灰的仪器名称为____________________。
(2)为使氨气和氯气在D中充分混合并反应,上述装置的连接顺序为a→d→c→____、_____←j←i←h←g←b。
(3)装置D处除易堵塞导管外,还有不足之处为______________________。
(4)检验氨气和氯气反应有岩脑砂生成时,除了蒸馏水、稀HNO3、AgNO3溶液、红色石蕊试纸外,还需要的试剂为_______________________。
Ⅱ.天然岩脑砂中NH4Cl纯度的测定(杂质不影响NH4Cl纯度测定)
已知:2NH4Cl+3CuO![]() 3Cu+2HCl↑+N2↑+3H2O。
3Cu+2HCl↑+N2↑+3H2O。
步骤:①准确称取1.19g岩脑砂;②将岩脑砂与足量的氧化铜混合加热(装置如下)。

(1)连接好仪器后,检查装置的气密性时,先将H和K中装入蒸馏水,然后加热G,____,则气密性良好。
(2)装置H的作用___________________________。
(3)实验结束后,装置I增重0.73g,则天然岩脑砂中NH4Cl的质量分数为_________________。
(4)若用K中气体体积测定NH4Cl纯度,当量气管内液面低于量筒内液面时,所测纯度______(填“偏高”、“ 无影响”或“偏低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),下列有关Ts的说法不正确的是( )
”,tián),下列有关Ts的说法不正确的是( )
A. Ts的电子所在最高能层符号是Q B. Ts的原子有一个未配对电子
C. Ts的电负性在同周期主族元素中最大 D. Ts原子有7种能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B. 氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓
D. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com