
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,左下图为其工作原理,右下图为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是( )


A. 正极反应式是O2+4H++4e-=2H2O,Cr2O72-+14H++6e-=2Cr3++7H2O
B. 电池工作时,N极附近溶液pH增大
C. 处理1molCr2O72-时有6molH+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
【答案】C
【解析】
A、根据工作原理,电解质环境为H+,根据原电池的工作原理,电子流入的一极为正极,即N极为正极,电极反应式为O2+4H++4e-=2H2O,Cr2O72-+14H++6e-=2Cr3++7H2O,故A说法正确;B、根据选项A的分析,消耗H+,N极附近溶液的pH升高,故B说法正确;C、正极反应式为O2+4H++4e-=2H2O,Cr2O72-+14H++6e-=2Cr3++7H2O,消耗1molCr2O72-时,从交换膜左侧向右侧迁移至少有14molH+,故C说法错误;D、根据右边的图,当Cr2O72-浓度大时去除率变为0,Cr2O72-离子浓度较大时,可能会造成还原菌失活,故D说法正确。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的热点。
(1) NaBH4是一神重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________,反应消耗1molNaBH4时转移的电子数目为___________。
(2) H2S热分解可制氢气。反应方程式:2H2S(g)=2H2(g)+S2(g) △H;在恒容密闭容器中,测得H2S分解的转化率(H2S起始浓度均为c mol/L)如图1所示。图l中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。

①△H ______0(填“>”“<”或“=”);
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=_____(用含c、t的代数式表示);
③请说明随温度升高,曲线b向曲线a接近的原因____________。
(3) 使用石油裂解的副产物CH4可制取H2,某温度下,向体积为2L的密闭容器中充入0.40mol CH4(g)和0.60molH2O(g)的浓度随时间的变化如下表所示:

①写出此反应的化学方程式_________,此温度下该反应的平衡常数是_________。
②3 min时改变的反应条件是_________(只填一种条件的改变)。
③一定条件下CH4的平衡转化率与温度、压强的关系如图2所示。则P1_________P2填“>”、“<”或“=“)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物![]() (W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下:
(W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下:

已知:
i.R1CHO+R2CH2CHO ![]()
![]()
ii.![]()
iii.R1CH=CHR2+R3CH=CHR4![]() R1CH=CHR4+R2CH=CHR3
R1CH=CHR4+R2CH=CHR3
(R代表烃基或氢原子)
(1)E所含的官能团名称是_____。
(2)N的名称是_____。
(3)②的反应类型是_____。
(4)①的化学方程式是_____。③的化学方程式是_____。
(5)X的结构简式是_____。
(6)Q有多种同分异构体,其中符合下列条件的有_____种。
①属于芳香类化合物且苯环上只有两个侧链
②遇FeCl3溶液显紫色
③苯环上的一氯代物只有两种
其中符合核磁共振氢谱中峰面积之比1:2:2:1:6的结构简式为_____(写出其中一种即可)。
(7)请以CH3CH2OH为原料(无机试剂任选),用不超过4步的反应合成CH3CH2CH2COOH,试写出合成流程图__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像符合题意的是
A. 在盐酸和氯化铝的混合溶液中滴加烧碱溶液
B. 在碳酸钠与碳酸氢钠混合液中滴加盐酸
C. 在氢氧化钠溶液中通入氯气
D. 在氢氧化钡溶液中滴加碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳香烃是指两个或两个以上的苯环通过共用环边所构成的多环有机化合物。常见的稠环芳香烃如萘、蒽、菲、芘等,其结构分别为
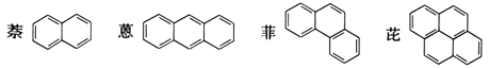
下列说法不正确的是( )
A. 萘与H2完全加成后,产物的分子式为C10H18
B. 蒽、菲、芘的一氯代物分别有3种、5种、5种
C. 上述四种物质的分子中,所有碳原子均共平面
D. 上述四种物质均能发生加成反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为________。
(2)2-巯基烟酸( )水溶性优于2–巯基烟酸氧钒配合物(
)水溶性优于2–巯基烟酸氧钒配合物( )的原因是___________________________________________________________________。
)的原因是___________________________________________________________________。
(3)各原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)尿素(H2NCONH2)尿素分子中,原子杂化轨道类型有________,σ键与π键数目之比为________。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如左下图)和六方氮化硼(如右下图),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。左上图中原子坐标参数A为(0,0,0),D为(![]() ,
,![]() ,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(
,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(![]() =1.732)。
=1.732)。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表这式为________pm。(已知正六边形面积为![]() a2,a为边长)
a2,a为边长)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol/ L NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 反应的过程中产生的白色沉淀为CaCO3
C. 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
D. 加入CaCl2促进了HCO3-的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)=2HI(g)△H<0(用“加快”、“减慢”、“不变”填空)
(1)保持容器容积不变,向其中加入1molH2,反应速率_________
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率________
(3)保持容器内压强不变,向其中加入1molN2(N2不参加反应),反应速率______
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率______
(5)提高起始的反应温度,反应速率___________
(6)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0若起始时c(CO)=2molL-1,c(H2O)=3molL-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)ClO2的制备及性质探究(如图所示)。

①仪器a的名称为________,装置B的作用是________。
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_________。装置D中滴有几滴淀粉溶液,其作用是________________。
③装置E用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为________,氧化产物是___________。
(2)粗略测定生成ClO2的量
实验步骤如下:
a. 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤D瓶2~3次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b. 从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去24.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是_____________。
②进入装置D中的ClO2质量为_______,与C中ClO2的理论产量相比,测定值偏低,可能的原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com