
【题目】已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl、OH、NO3—六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有__________种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为__________(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是_________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为_____________、____________。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为________________。
【答案】3BMgAg++Cl===AgCl↓Mg2++2OH=== Mg(OH)2↓n(K+)∶n(Mg2+)∶n(![]() )=4∶1∶6
)=4∶1∶6
【解析】
向试管A的溶液中滴入酚酞试液呈粉红色,说明溶液显碱性,一定含有OH-,根据离子共存原理,A中一定没有Ag+、Mg2+,则A中含有的阳离子只能是K+;试管B中一定含有Ag+、Mg2+,则一定没有Cl-,B中含有的阴离子一定是NO3-;
综上所述,试管A中含有K+、OH-、Cl-,试管B中含有Ag+、Mg2+、NO3-,以此分析解答。
(1)根据以上分析,试管A中含有K+、OH-、Cl-,共有3种。
故答案为:3;
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管中含有Ag+,为试管B。
故答案为:B;
(3)若向试管B的溶液中加入合适的药品,过滤后溶液中仅含有一种溶质,且得到相应的金属,应该发生置换反应,且不引入其他离子,则加入药品是Mg,Mg+2Ag+=Mg2++2Ag。故答案为:Mg;
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则Ag+与Cl-恰好完全反应,Mg2+和OH-恰好完全反应,混合过程中发生反应的离子方程式为:Ag++Cl-=AgCl↓、Mg2++2OH-=Mg(OH)2↓。
故答案为:Ag++Cl-=AgCl↓;Mg2++2OH-=Mg(OH)2↓;
(5)设KOH、KCl、Mg(NO3)2、AgNO3四种物质均为1mol,溶解于试管中,过滤后所得滤液中含有2molK+、0.5molMg2+、3mol NO3-,则n(K+):n(Mg2+):n(NO3-)=2:0.5:3=4:1:6。
故答案为:n(K+):n(Mg2+):n(NO3-)= 4:1:6。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,对该反应的下列说法中正确的是( )
2SO3(g)为放热反应,对该反应的下列说法中正确的是( )
A. 1mol O2(g)的能量一定高于2mol SO2(g)的能量
B. 2mol SO2(s)和1mol O2(g)的总能量一定高于2mol SO3(g)的总能量
C. 2mol SO3(g)的总能量一定低于2mol SO2(g)和1mol O2(g)的总能量
D. 因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四种烃的有关说法正确的是
①![]() ②
②
③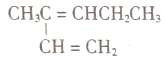 ④
④
A. ①催化加氢可生成3-甲基已烷 B. ③与④催化加氢后的产物质谱图完全一样
C. ③中所有碳原子有可能共平面 D. ②在同一直线上的碳原子有5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 乳酸薄荷醇酯(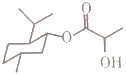 )能发生水解、氧化、消去反应
)能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,但它们与氢气充分反应后的产物是同系物
)不是同系物,但它们与氢气充分反应后的产物是同系物
C. 淀粉和纤维素完全水解后的产物都是葡萄糖,但淀粉是人体的营养物质而纤维素不是
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是____,负极发生的电极反应方程式为:____。若反应消耗32.5 g 负极材料,则电池中转移电子的数目为____。

(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,(充电是指外加电流作用发生氧化还原反应)已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,(充电是指外加电流作用发生氧化还原反应)已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①上述反应可以在酸性条件下进行 ②上述反应不是可逆反应
③放电时正极金属Cd的质量增加 ④放电时化学能转变为电能
(3)如图为氢氧燃料电池的构造示意图,电解质溶液的溶质是KOH。则X极为电池的_____(填“正”或“负”)极,X极的电极反应方程为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(![]() )是一种具有咸味、有毒、具有防腐性,且价格比食盐(
)是一种具有咸味、有毒、具有防腐性,且价格比食盐(![]() )便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生,它的部分性质如右图,下列说法错误的是( )
)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生,它的部分性质如右图,下列说法错误的是( )

A. 可用淀粉碘化钾试纸和食醋鉴别食盐(![]() )与亚硝酸钠(
)与亚硝酸钠(![]() )
)
B. 亚硝酸钠可以加到食品中,但添加量要符合规定
C. ![]() 与
与![]() 反应生成
反应生成![]() 的化学方程式为
的化学方程式为![]()
D. 上图所涉及的化学反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究
①实验Ⅰ中生成红色物质的离子方程式为: __________________________________________
②请写出60s后反应进一步加快可能的原因(写出一条)________________________________________________________________
(2)对实验Ⅱ进行研究
①实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
②假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
③假设二:________________________________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
①实验Ⅵ的设计目的是:_______________________________________________
②其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________
③其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com