
【题目】关于下列四种烃的有关说法正确的是
①![]() ②
②
③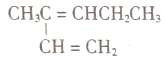 ④
④
A. ①催化加氢可生成3-甲基已烷 B. ③与④催化加氢后的产物质谱图完全一样
C. ③中所有碳原子有可能共平面 D. ②在同一直线上的碳原子有5个
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)(3)(4)图中分别有OA<AB,OA=AB,OA>AB,

则下列分析与判断不正确的是
A、M中只有一种溶质的有(1)和(3)
B、M中有两种溶质的有(2)和(4)
C、(2)图显示M中c(NaHCO3)<c(Na2CO3)
D、(4)图显示M中的溶质为NaOH和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1molCl2参加反应转移电子数一定为2NA
B. 在16g18O2中含有10NA个中子
C. 标准状况下,22.4L HF中含2NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列家庭小实验中,不涉及化学变化的是
A. “84”消毒液对炊具消毒 B. 利用太阳能蒸发海水制取淡水
C. 过氧化钠漂白羽毛、织物 D. 用少量食醋除去水壶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,0.01mol/L CH3COOH溶液中c(H+)=4.32×10-4mol/L,则该CH3COOH溶液中水的离子积常数为( )
A.<1×10-14B.>1×10-14C.=1×10-14D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_______。
(2)高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
① Na2FeO4中铁元素的化合价是______价。
② 用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是_______(用离子方程式表示)。
③ 工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 +10NaOH+3NaClO=2_____+5_____+9_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl、OH、NO3—六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有__________种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为__________(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是_________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为_____________、____________。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学利用MnO2和浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置(数量可满足需要,不含制气装置)如下,下列说法正确的是( )

A. 装置E中发生反应的离子方程式为:Cl2+OH-=Cl-+ClO-+H2O
B. 按气流流动的先后顺序,装置连接顺序依次为DABAE
C. 装置E的主要用途是制备NaClO
D. 装置D的作用是除去氯气中的HCl并提供水蒸气以验证HClO具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸与金属的反应是我们一直探讨和研究的重要课题之一。
Ⅰ.铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O。则a:b=______.
cCu2S+dCuSO4+eH2O。则a:b=______.
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
(探究一)(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是________;
(2)铁与浓硫酸在加热时的化学方程式为:______________;
(3)称取碳素钢6.0g放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用____________;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为_______;
(探究二)根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体在标准状况下密度为0.0893g/L。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
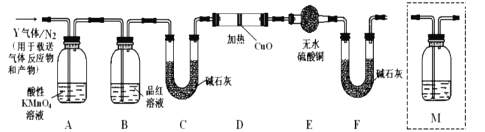
(4)装置B中试剂的作用是__________;
(5)分析Y气体中的![]() 气体是如何生成的___________(用化学方程式表示):
气体是如何生成的___________(用化学方程式表示):
(6)为确认![]() 的存在,需在装置中添加洗气瓶M于___________;
的存在,需在装置中添加洗气瓶M于___________;
a.A之前 b.A-B间 c.B-C间 d.C-D间
(7)如果气体Y中含有![]() ,预计实验现象应是_________________。
,预计实验现象应是_________________。
Ⅲ.将一定质量的Zn与100mL一定浓度的H2SO4充分反应:
(1)若反应前c(H2SO4)=12.0mol/L,反应后称量剩余锌发现质量减少了65.0g。将反应后的溶液稀释至1L,此时溶液中c(SO42-)=______mo/L,产生SO2体积(标准状况下)V(SO2)=______L;
(2)将(1)中产生的气体缓缓通入100mL a mo/L NaOH溶液中,SO2和NaOH都完全消耗,则a的取值范围为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com