
【题目】某研究性学习小组的同学利用MnO2和浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置(数量可满足需要,不含制气装置)如下,下列说法正确的是( )

A. 装置E中发生反应的离子方程式为:Cl2+OH-=Cl-+ClO-+H2O
B. 按气流流动的先后顺序,装置连接顺序依次为DABAE
C. 装置E的主要用途是制备NaClO
D. 装置D的作用是除去氯气中的HCl并提供水蒸气以验证HClO具有漂白性
【答案】B
【解析】
A.电荷、原子不守恒,离子方程式应该为:Cl2+2OH-=Cl-+ClO-+H2O,A错误;
B.用浓盐酸与MnO2混合加热制取Cl2,由于盐酸具有挥发性,在Cl2中含有杂质HCl及水蒸气,先通过D装置除去HCl,再通过A装置除去水蒸气,得到干燥纯净的氯气,然后通过B验证Cl2是否具有漂白性,在通过C验证潮湿的氯气具有漂白性,由于氯气会导致大气污染,因此最后通过NaOH溶液进行尾气处理,故使用的装置的先后顺序为DABAE,B正确;
C.装置E的主要用途是吸收尾气,防止污染空气,C错误;
D.装置D的作用是除去氯气中的HCl,并抑制Cl2与水的反应的发生,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】在一定温度时,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应A(s)+2B(g)![]() C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
A. 在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol/(Lmin)
B. 5 min时,容器内D的浓度为0.2 mol/L
C. 该可逆反应随着反应的进行,容器内压强逐渐增大
D. 5 min时,容器内气体总的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四种烃的有关说法正确的是
①![]() ②
②
③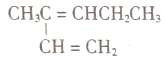 ④
④
A. ①催化加氢可生成3-甲基已烷 B. ③与④催化加氢后的产物质谱图完全一样
C. ③中所有碳原子有可能共平面 D. ②在同一直线上的碳原子有5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是____,负极发生的电极反应方程式为:____。若反应消耗32.5 g 负极材料,则电池中转移电子的数目为____。

(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,(充电是指外加电流作用发生氧化还原反应)已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,(充电是指外加电流作用发生氧化还原反应)已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①上述反应可以在酸性条件下进行 ②上述反应不是可逆反应
③放电时正极金属Cd的质量增加 ④放电时化学能转变为电能
(3)如图为氢氧燃料电池的构造示意图,电解质溶液的溶质是KOH。则X极为电池的_____(填“正”或“负”)极,X极的电极反应方程为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(![]() )是一种具有咸味、有毒、具有防腐性,且价格比食盐(
)是一种具有咸味、有毒、具有防腐性,且价格比食盐(![]() )便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生,它的部分性质如右图,下列说法错误的是( )
)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生,它的部分性质如右图,下列说法错误的是( )

A. 可用淀粉碘化钾试纸和食醋鉴别食盐(![]() )与亚硝酸钠(
)与亚硝酸钠(![]() )
)
B. 亚硝酸钠可以加到食品中,但添加量要符合规定
C. ![]() 与
与![]() 反应生成
反应生成![]() 的化学方程式为
的化学方程式为![]()
D. 上图所涉及的化学反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
①CS2为V形的极性分子 ②ClO![]() 的空间构型为平面三角形
的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对 ④SiF4和SO![]() 的中心原子均为sp3杂化
的中心原子均为sp3杂化
A. ①② B. ②③ C. ③④ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
A | 2p能级电子半充满 |
B | 与A同周期,且原子核外有2个未成对电子 |
C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
D | 其基态原子外围电子排布为msnmpn+2 |
E | 前四周期元素中,E元素基态原子未成对电子数最多 |
F | 基态F+各能级电子全充满 |
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______种能量不同的电子,电子排布式为________________,写出F元素基态原子的价电子排布图________________。
(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为________。
(3)A、B、C、D四种元素:(用元素符号表示,下同)
①原子半径由小到大的顺序是___________________;
②第一电离能由大到小的顺序为__________________;
③电负性由大到小的顺序是____________________。
(4)判断下列分子或离子中空间构型是V形的是________(填写序号)。
a.SO2 b.H2O c.NO![]() d.NO
d.NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com