
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式____________。
②由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_____________。
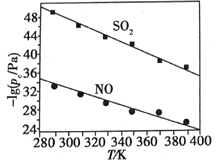
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如图所示。
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为________________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是______________。
②已知下列反应:
SO2(g)+2OH (aq) =SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) =SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=_______。
【答案】4OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O 大于 NO溶解度较低或脱硝反应活化能较高 减小 K = ![]() 形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高 △H1+△H2-△H3
形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高 △H1+△H2-△H3
【解析】
(1)①亚氯酸钠具有氧化性,会将NO氧化成NO3-,且NaClO2溶液呈碱性,据此分析作答;
②由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率.原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化;
(2)①由图分析可知,根据反应3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O,NO的平衡分压的负对数随温度的升高而减小,则说明温度越高,NO的平衡分压越大,NO的含量越高,故升高温度,平衡向逆反应方向进行,平衡常数减小;
②化学平衡常数是指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,根据平衡常数的定义列出具体表达式;
(3)①如果采用NaClO、Ca(ClO)2替代NaClO2,由于生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行;
②根据盖斯定律计算。
(1)①亚氯酸钠具有氧化性,且NaClO2溶液呈碱性,则NaClO2溶液脱硝过程中主要反应的离子方程式为:3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O;正反应是体积减小的,则增加压强,NO的转化率提高,
故答案为:3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O;提高;
②由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高,
故答案为:大于;NO溶解度较低或脱硝反应活化能较高;
(2)①由图分析可知,根据反应3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O,NO的平衡分压的负对数随温度的升高而减小,则说明温度越高,NO的平衡分压越大,NO的含量越高,故升高温度,平衡向逆反应方向进行,平衡常数减小,故答案为:减小;
②反应ClO2+2SO32-===2SO42-+Cl的平衡常数K表达式为:K = ![]() ,
,
故答案为K = ![]() ;
;
(3)①如果采用NaClO、Ca(ClO)2替代NaClO2,生成硫酸钙沉淀,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好,
故答案为:形成CaSO4沉淀,降低硫酸根离子浓度,反应平衡向产物方向移动,SO2转化率提高;
②SO2(g)+2OH (aq) =SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) =SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则根据盖斯定律可知①+②③即得到反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq),则△H1+△H2-△H3,
故答案为:△H1+△H2-△H3。


科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )

A. N4属于一种新型的化合物B. N4分子中存在极性键
C. N4分子中N—N键角为109°28′D. 1 mol N4转变成N2将放出882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3He可以作为核聚变材料,以下关于3He的说法正确的是
A.比4He少一个质子B.比4He多一个中子
C.是4He的同素异形体D.是4He的同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D. 滤液加稀盐酸时只发生反应:H+ +OH- =H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.用氢氧化钠溶液清洗沾在皮肤上的苯酚B.用浓硫酸吸收氨气中的水分
C.用稀硝酸洗去残留在试管内壁上的银D.用酒精萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
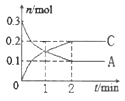
A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如下图所示。下列说法错误的是
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如下图所示。下列说法错误的是

A. 0~5 min,CO2的平均反应速率为0.04 mol·L-1·min-1
B. 在T2 ℃时,若反应处于状态D,则v正<v逆
C. 反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH<0
CH3OH(g)+H2O(g)的ΔH<0
D. 若T1 ℃、T2 ℃时的平衡常数分别为K1、K2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中大量共存的一组离子是
A. NH4+、Ag+、PO43-、Cl- B. Fe3+、H+、I-、HCO3-
C. K+、Na+、NO3-、MnO4- D. NH4+、Al3+、SO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com