
(10分)湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程。

(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为__________。
(2)浸出液以硫酸锌为主,还含有Fe3+、Fe2+、A13+、Cu2+、Cd2+、C1一等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为______________________。
②将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的试剂为_____(填字母)
A.NaOH B.NH3·H2 O C.ZnO D.H2 SO4
③用Zn除去Cu2+和Cd2+
④用Ag2SO4除去Cl一,发生的反应为Ag2SO4+2Cl一 2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)=6.0x 10-5,Ksp(AgCl)=2.0x 10-10]。
2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)=6.0x 10-5,Ksp(AgCl)=2.0x 10-10]。
(3)控制一定条件,用惰性电极电解硫酸锌溶液制取锌,锌在____极析出,阳极反应式为__________。
(1)硫酸 (或H2SO4) (1分)(2)① 2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O(2分)
②C(2分) ④ 1.5×1015(2分)
(3)阴(1分) 2H2O - 4e-=O2↑+4H + (写 4OH- - 4e-=O2↑+ 2H2O 也可) (2分)
【解析】
试题分析:(1)ZnS燃烧时S元素转化为SO2,SO2是大气污染物,因此烟气不能直接排放。SO2可以被氧化最终转化为硫酸。
(2)①双氧水具有氧化性,则在酸性条件下,H2O2将Fe2+氧化成Fe3+的离子方程式为2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O。
②由于不能引入新的杂质,所以只能选择氧化锌调节溶液的pH,答案选C。
④根据反应Ag2SO4+2Cl一 2AgCl+ SO42-可知室温下该反应的平衡常数
2AgCl+ SO42-可知室温下该反应的平衡常数
K=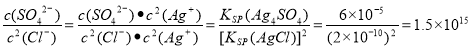 。
。
(3)电解池中阳极失去电子,发生氧化反应,阴极得到电子发生还原反应,则锌离子在阴极放电析出锌。阳极是溶液中的氢氧根离子放电,则阳极反应式为4OH- - 4e-=O2↑+ 2H2O。
考点:考查物质制备工艺流程图的分析与应用


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(15分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1 = a kJmol-1
CO(g) + H2O (g)=CO2(g) + H2 (g) ΔH2 = b kJmol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJmol-1
反应CO2(g) + CH4(g) 2CO(g) + 2H2(g) 的ΔH= kJmol-1。
2CO(g) + 2H2(g) 的ΔH= kJmol-1。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。

① 在不同温度下催化剂的催化效率与乙酸的生成速率如图8所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
② 为了提高该反应中CH4的转化率,可以采取的措施是 。
③ 将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)以CO2为原料可以合成多种物质。
① 利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1molFe3O4,转移电子的物质的量为 mol。
② 以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的 极,则该电解反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.Na2O2与足量H2O反应,共生成2.24LO2,转移电子的数目为0.2NA
B.1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA
C.标准状况下,2.24 L己烷含有分子的数目为0.1NA
D.1mol Na2O和Na2O2固体混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:填空题
(14分)节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g),△H<0
CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。

①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)= ;平衡时,容器中CO的转化率为 。
②下图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是 。(写出一条)

(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g) CO2(g)降低其浓度。
CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请在表中的空格处填写“>"“<”或“="。

②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为 mol/L(请保留两位有效数字)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:选择题
用下列实验装置和方法进行相应实验,能达到实验目的的是
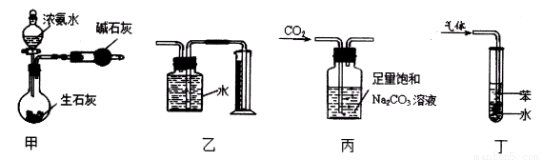
A.用甲装置制干燥的氨气
B.用乙装置收集并测量Cu与浓硝酸反应产生的气体及体积
C.用丙装置除去CO2中含有的少量HC1
D.用丁装置吸收NH3,并防止倒吸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列物质性质与应用及其对应关系均正确的是
选项 | 性质 | 应用 |
A | 碳酸氢钠可与烧碱反应 | 可用碳酸氢钠作糕点膨松剂 |
B | AgCl难溶于稀硝酸 | 可用稀硝酸和AgNO3溶液检测Cl一 |
C | 浓硫酸具有强氧化性,而稀硫酸的氧化性较弱 | 可用浓硫酸替代稀硫酸与锌反应快速制氢气 |
D | 碳单质性质稳定 | 可在纯铁中加入少量炭增强抗腐蚀性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列方程式错误的是
A.0.1mol·L-1CH3 COOH溶液的pH为3:CH3 COOH H++CH3 COO—
H++CH3 COO—
B.A1Cl3溶液中加入过量稀氨水:A13++3NH3·H2 O=A1(OH)3↓+3 NH4+
C.C12与过量的铁反应:3C12+2Fe 2FeCl3
2FeCl3
D.NaHCO3溶液中加入稀盐酸:CO32一+2H+=CO2↑+H2 O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
已知HCN、CN—在溶液中存在下列平衡及其对应的平衡常数:
①HCN H++CN— △H1>0 K1
H++CN— △H1>0 K1
②CN— +H2O HCN+OH- △H 2>0 K2
HCN+OH- △H 2>0 K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是
A.混合溶液的pH<7
B.对混合溶液进行微热,K1 增大、K2 减小
C.K2≈ 1.6×10-5
D.c(Na+) = c(HCN) + c(CN‑)
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省咸宁市高一上学期期末考试化学(B)试卷(解析版) 题型:填空题
A、B、C、D、E、F、G、H、I均是中学化学中常见的气体,它们均由前18号元素组成,具有如下性质:
①A、E、F、G能使湿润的蓝色石蕊试纸变红,B能使湿润的蓝色石蕊试纸先变红后褪色,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白;
③B和E都能使品红溶液褪色;
④将红热的铁丝伸入装有B的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条伸入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H在瓶中混合后在强光照射下产生A。
回答下列问题:
(1)④中发生反应的化学方程式是 。
(2)⑤中发生反应的化学方程式是 。
(3)C的化学式是 ,D的化学式是 。
(4)写出实验室制I的化学反应方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com