
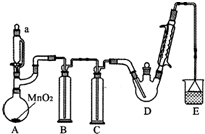
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
分析 A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl4CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;
(2)用饱和食盐水除去HCl;撤去B装置,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生;控制反应温度在70℃左右,应采取水浴加热;
(3)有机物易挥发性,冷凝回流挥发的有机物;E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,HCl与氢氧化钠反应生成氯化钠与水;
(4)CCl3COOH溶于乙醇与CCl3CHO;
(5)根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式:CCl3CHO~HCOO-~I2计算;
(6)a.酸性越强,电离程度越大,溶液pH越小;
b.电离程度越大,酸性越强,溶液中离子浓度越大,导电能力越强;
c.酸性越弱,其钠盐的水解程度越大,溶液pH越大.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B装置用饱和食盐水除去HCl,减少副反应发生,撤去B装置,氯气中混有HCl,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生,导致装置D中副产物C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,偏于控制温度,
故答案为:饱和食盐水;C2H5Cl;水浴;
(3)有机物易挥发性,冷凝回流挥发的有机物;EE装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,
故答案为:冷凝回流;Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
(4)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,
故答案为:不可行,CCl3COOH溶于乙醇与CCl3CHO;
(5)根据消耗的Na2S2O3计算剩余I2的物质的量0.02000mol•L-1×0.02L×$\frac{1}{2}$=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol•L-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为$\frac{1.8×10{\;}^{-3}mol×147.5g/mol}{0.4g}$×100%=66.4%,
故答案为:66.4%;
(6)a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故a正确;
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱,三氯乙酸溶液中离子浓度更大,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故b正确;
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大,说明乙酸钠的水解程度更大,则乙酸的酸性比三氯乙酸的弱,故c正确,
故选:abc.
点评 本题考查有机物制备、物质含量程度、实验方案设计等,关键是明确反应原理与各装置作用,掌握常用物质分离提纯方法,注意对题目信息的应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过灼热的铁粉生成氢氧化铁和氢气 | |
| B. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| C. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| D. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
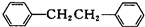 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: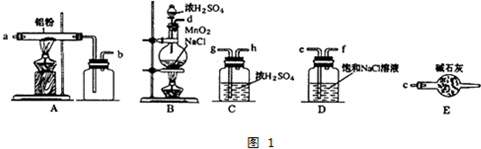

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时锌为负极 | |
| B. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═2MnOOH+2OH- | |
| C. | 电池工作时,电解液的OH-移向正极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com