
【题目】请按要求书写下列离子方程式:
①将过量CO2通入澄清石灰水中,反应的离子方程式为_____________________。
②Ca(HCO3)2溶液与少量Ca(OH)2溶液反应的离子方程式为___________________。
③少量Ba(OH)2溶液与NaHSO4溶液反应的离子方程式为_____________。
④已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为__。
⑤在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,该过程的离子反应方程式为___。
还原为Cr3+,该过程的离子反应方程式为___。
【答案】CO2+OH-= HCO3— Ca2++HCO3—+OH-=CaCO3↓+H2O Ba2++2OH-+2H++SO42—= BaSO4↓+2H2O H2O+ ClO-+ Mn2+ =MnO2+2H++Cl- 5Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】
①将过量CO2通入澄清石灰水中,二氧化碳与氢氧化钙反应生成碳酸氢钙;
②Ca(HCO3)2溶液与少量Ca(OH)2溶液反应生成碳酸钙沉淀;
③少量Ba(OH)2溶液与NaHSO4溶液反应,消耗完氢氧根离子,生成硫酸钡沉淀和水;
④酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,反应微粒为水、次氯酸根离子、二价锰离子,生成二氧化锰、氯离子和氢离子;
⑤酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,反应离子为重铬酸根离子、亚铁离子、氢离子,生成3价铬离子、铁离子和水。
还原为Cr3+,反应离子为重铬酸根离子、亚铁离子、氢离子,生成3价铬离子、铁离子和水。
①将过量CO2通入澄清石灰水中,二氧化碳与氢氧化钙反应生成碳酸氢钙,反应的离子方程式为CO2+OH-= HCO3—;
②Ca(HCO3)2溶液与少量Ca(OH)2溶液反应生成碳酸钙沉淀,反应的离子方程式为Ca2++HCO3—+OH-=CaCO3↓+H2O;
③少量Ba(OH)2溶液与NaHSO4溶液反应,消耗完氢氧根离子,生成硫酸钡沉淀和水,反应的离子方程式为Ba2++2OH-+2H++SO42—= BaSO4↓+2H2O;
④酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,反应微粒为水、次氯酸根离子、二价锰离子,生成二氧化锰、氯离子和氢离子,离子方程式为H2O+ ClO-+ Mn2+ =MnO2+2H++Cl-;
⑤酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,反应离子为重铬酸根离子、亚铁离子、氢离子,生成3价铬离子、铁离子和水,离子方程式为5Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。
还原为Cr3+,反应离子为重铬酸根离子、亚铁离子、氢离子,生成3价铬离子、铁离子和水,离子方程式为5Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。


科目:高中化学 来源: 题型:
【题目】标况下把V体积氨气溶于1体积水中得到氨的饱和溶液,试完成下列填空。
(1)NH3通入水中发生的反应为____________________。
(2)氨水中存在的分子有__________________________。
(3)氨水中存在的离子有__________________________。
(4)所得氨水的质量分数为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。下面列出了几组物质,请将物质的合适组号填写在空格上。
A.金刚石与石墨;B.氕与氘;C.甲烷与戊烷;D.![]() 与
与 ;E.
;E.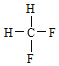 与
与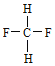 。
。
(1)同素异形体___;(2)同系物___;(3)同分异构体___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
 ______________;
______________; ______________。
______________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。
BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)将N2转化为含氮化合物的过程称为固氮。
①人工固氮,将N2→NH3,N2发生___反应(填“氧化”或“还原”)
②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3![]() Ca(NO3)2。
Ca(NO3)2。
写出NO→NO2→HNO3的化学方程式___、___。
将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M___(写化学式)。
(2)科学合理地保存、施用氮肥。
①NH4HCO3需阴凉处保存,原因是___(写化学方程式)。
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式___。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如图所示(转化所需试剂及条件已略去):

①Y与NH3反应生成(NH4)2SO4的化学方程式___。
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3。则尿素中C元素化合价为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质投入溶液中,溶液质量减轻的是( )
A.CaCO3投入到HCl溶液中
B.Na2CO3投入稀硫酸中
C.Fe粉投入CuSO4溶液中
D.Fe粉投入稀HCl溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
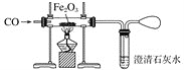
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如下装置制备乙酸乙酯。下列有关分析不正确的是

A. b中导管不能插入液面下,否则会阻碍产物的导出
B. 固体酒精是一种白色凝胶状纯净物,常用于餐馆或野外就餐
C. 乙酸乙酯与![]() 互为同分异构体
互为同分异构体
D. 乙酸、水、乙醇羟基氢的活泼性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:

下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com