
【题目】标况下把V体积氨气溶于1体积水中得到氨的饱和溶液,试完成下列填空。
(1)NH3通入水中发生的反应为____________________。
(2)氨水中存在的分子有__________________________。
(3)氨水中存在的离子有__________________________。
(4)所得氨水的质量分数为________________________。
【答案】NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-; H2O、NH3、NH3·H2O NH4+、OH-、H+
NH4++OH-; H2O、NH3、NH3·H2O NH4+、OH-、H+ 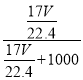 ×100%
×100%
【解析】
(1)NH3通入水中,大部分氨气与水化合生成NH3·H2O,产生NH3·H2O的少部分发生电离生成NH4+和OH-,反应的化学方程式为NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-;
NH4++OH-;
(2)在氨水中存在氨气与水反应的化合平衡,一水合氨的电离平衡及水的电离平衡,所以氨水中存在的分子,H2O、NH3、NH3·H2O;
(3)由于在氨水中存在三个平衡:氨气与水反应的化合平衡,一水合氨的电离平衡及水的电离平衡,所以在氨水中存在的离子有NH4+、OH-、H+;
(4)标况下VL氨气的物质的量为n(NH3)=![]() ,其质量为m(NH3)=nM=
,其质量为m(NH3)=nM=![]() ×17g/mol=
×17g/mol=![]() g;将其溶于1L水中,得到的溶液的质量为m=m(氨)+m(水)=
g;将其溶于1L水中,得到的溶液的质量为m=m(氨)+m(水)=![]() g,所以该溶液的质量分数为
g,所以该溶液的质量分数为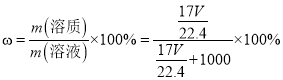 。
。


科目:高中化学 来源: 题型:
【题目】可从铅蓄电池中回收铅,实现铅的再生。在工艺中得到含Na2PbCl4的电解液,电解Na2PbCl4溶液后生成Pb,如图所示。下列说法不正确的是

A. 阳极区会有气泡冒出,产生O2
B. 一段时间后,阳极附近pH明显增大
C. 阴极的电极反应方程式为PbCl42+ 2e ![]() Pb + 4Cl-
Pb + 4Cl-
D. Na2PbCl4浓度下降后可在阴极区加入PbO,实现电解液的继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种神经保护剂的中间体,某种合成路线如下:

根据上述转化关系,回答下列问题:
(1)芳香族化合物A的名称是___。
(2)D中所含官能团的名称是____。
(3)B—C的反应方程式为____。
(4)F—G的反应类型___。
(5)G的同分异构体能同时满足下列条件的共有____种(不含立体异构);
①芳香族化合物②能发生银镜反应,且只有一种官能团,其中,核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:3的是__(写出一种结构简式)。
(6)参照上述合成路线,写出以![]() 和BrCH2COOC2H5为原料(无机试剂任选),制备
和BrCH2COOC2H5为原料(无机试剂任选),制备 的合成路线____________。
的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:
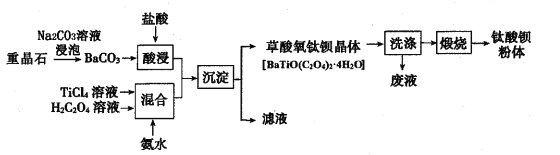
回答下列问题:
(l)为提高BaCO3的酸浸速率,可采取的措施为__(写出一条即可);常温下,TiCl4为液体且易水解,配制一定浓度的TiCl4溶液的方法是 ____。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ___(填写计算结果);若不考虑CO32-的水解,要使2. 33g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液 ___mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
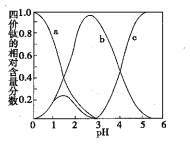
(3)流程中“混合”溶液的钛元素在不同pH时主要以TiO(OH)+、TiOC2O4、TiO(C2O4)22-三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH于2.8左右,再进行“沉淀”,其反应的离子方程式为____;图中曲线c对应钛的形式为____(填粒子符号)。
(4)流程中“滤液”的主要成分为____;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,22.4 L CCl4、CO2含有的分子数为1NA
B.常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是

A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求书写下列离子方程式:
①将过量CO2通入澄清石灰水中,反应的离子方程式为_____________________。
②Ca(HCO3)2溶液与少量Ca(OH)2溶液反应的离子方程式为___________________。
③少量Ba(OH)2溶液与NaHSO4溶液反应的离子方程式为_____________。
④已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为__。
⑤在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,该过程的离子反应方程式为___。
还原为Cr3+,该过程的离子反应方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com