
【题目】某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( )
A. 黑色固体是碳
B. 钠在燃烧时只发生了一个反应
C. 钠在金属活动性顺序中排在镁前面,所以钠能与二氧化碳反应(已知:2Mg+CO2![]() 2MgO+C)
2MgO+C)
D. 钠保存在煤油中,可能滤纸没有完全吸干煤油,煤油不完全燃烧产生碳
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g),图1是在两种投料比[c(CO2)/c(H2+ CO)]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线, 图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图
CH3OH(g)+ H2O(g),图1是在两种投料比[c(CO2)/c(H2+ CO)]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线, 图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图
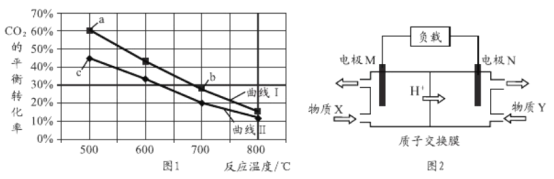
下列有关说法正确的是
A. 图1中b点对应的平衡常数K值大于c点
B. 图1中a点对应的H2的转化率等于30%
C. 图2中电极M上发生还原反应
D. 图2中电极N的反应式: H2O2 +2e- + 2H+= 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内的两种物质发生反应时,其产物不随反应物用量比的改变而发生变化的是
A. C和O2 B. NaOH溶液和CO2
C. Na2CO3溶液和盐酸 D. Na和Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 在标准状况下,以任意比例混合的CH4与CO2的混合物22.4L,所含有的分子数为NA
B. 在标准状况下,NA个H2O 分子所占体积为22.4L
C. 常温常压下, 1mol Cl2与氢氧化钠溶液反应,发生转移的电子数为2NA
D. 常温常压下,28g氮气含有的核外电子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
铬、锰、铁、钴、镍等过渡金属元索的单质及其化合物在工农业、国防、科技等领域具存广泛应用。
(1)基态Cr原子中有_________个未成对电子,最外层电子所占用能级的电子云形状为_______。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1d9排布时,有颜色。则:[Mn(H2O)6]2+ ________(填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示

①图1和图2中Fe原子的配位数分别为_______________和________________。
②若图2的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________pm。(用含ρ、NA的代数式表示)
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________NiO(填“>”“<”或“=”),理由是_______________。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________g。(用含ɑ、NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。
I.研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1:3、3:1、4:1时,NO脱除率随温度变化的曲线如图所示。

①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为___________________mg/(m3.s)。
②曲线b对应的NH3与NO的物质的量之比是_______,其理由是___________________。
(2)已知在25℃,101 kPa时:

请写出用NH3脱除NO的热化学方程式:_______________________________。
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下:

含硫各微粒(H2SO3、HSO3-和SO32-)存在于装置I反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如下图所示。

①溶液的pH=8时,溶液中各离子浓度由大到小的顺序是_________________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:___________________________。
(4)装置Ⅱ中NO转变为NO3-的反应的离子方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com