
【题目】(1)磷在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式_______。
(2)钛存在两种同素异形体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,由
采纳体心立方堆积,由![]() 转变为
转变为![]() 晶体体积______(填“膨胀”或“收缩”)
晶体体积______(填“膨胀”或“收缩”)
(3)[Cu(CH3CN)4]+是非常稳定的络合离子,配体中![]() 键和π键个数之比为_______。
键和π键个数之比为_______。
(4)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的Ka2_________苯酚(
,相同温度下,水杨酸的Ka2_________苯酚(![]() )的Ka(填“>”“ =”或“<”)
)的Ka(填“>”“ =”或“<”)
(5)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220![]() C。Cr(CO)6的晶体类型是_____,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的化学键类型为_______。
C。Cr(CO)6的晶体类型是_____,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的化学键类型为_______。
(6)已知N-N、N=N和N≡N键能之比为1.00:2.17:4.90.而C-C、C=C、C≡C键能之比为1.00:1.77:2.34.如何用这些数据理解氮分子不容易发生加成反应而乙炔容易发生加成反应?_____________。
(7)将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构——T-碳。已知T-碳密度为![]() g/cm,阿伏加德罗常数为NA,则T-碳的晶胞参数a=_______pm(写出表达式即可)
g/cm,阿伏加德罗常数为NA,则T-碳的晶胞参数a=_______pm(写出表达式即可)

【答案】ls22s22p63s13p33d1 膨胀 5:2 < 分子晶体 配位键 前者每多出两条键其键能大于原来的三倍,要破坏需要吸收的能置更多;后者每增加两条化学键其键能增加量却小于原来的3倍,要破坏需要吸收的能量更少; 
【解析】
(1)磷在成键时,能将一个3s电子激发进入3d能级,P原子的3s、3p、3d上有5个未成对电子;
(2)六方堆积是最密堆积,体心立方堆积不是最密堆积;
(3) [Cu(CH3CN)4]+的配体是CH3CN,CH3CN的结构式是  ;
;
(4)![]() 中形成分子内氢键,使该微粒中酚羟基更难电离出H+;
中形成分子内氢键,使该微粒中酚羟基更难电离出H+;
(5)根据六羰基铬沸点低判断晶体类型;Cr(CO)6中Cr与CO通过配位键结合;
(6)N≡N比N-N多出2条键,其键能大于原来的三倍;C≡C比C-C多出2条键,其键能小于原来的三倍;
(7)根据![]() 计算晶胞参数a。
计算晶胞参数a。
(1)磷在成键时,能将一个3s电子激发进入3d能级,P原子的3s、3d上各有1个未成对电子,该激发态原子的核外电子排布式ls22s22p63s13p33d1;
(2)六方堆积是最密堆积,体心立方堆积不是最密堆积;所以由![]() 转变为
转变为![]() 晶体体积膨胀;
晶体体积膨胀;
(3) CH3CN的结构式是  ,单键全是
,单键全是![]() 键,三键中有1个
键,三键中有1个![]() 键、2个π键,
键、2个π键,![]() 键和π键个数之比为5:2;
键和π键个数之比为5:2;
(4)![]() 中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚);
中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚);
(5)六羰基铬沸点低,所以属于分子晶体;Cr(CO)6中Cr与CO通过配位键结合,Cr(CO)6分解为高纯度铬粉和CO,破坏配位键;
(6) N≡N比N-N多出两条键其键能大于原来的三倍,要破坏需要吸收的能量更多;C≡C比C-C每增加两条化学键其键能增加量却小于原来的3倍,要破坏需要吸收的能量更少,所以氮分子不容易发生加成反应而乙炔容易发生加成反应。
(7)根据均摊原则,立方金刚石晶胞中碳原子数是![]() ,T-碳中碳原子数是8×4=32,T-碳晶胞的M=8×4×12=384g/mol;
,T-碳中碳原子数是8×4=32,T-碳晶胞的M=8×4×12=384g/mol;![]() ,a=
,a= =
=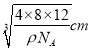 =
= pm。
pm。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
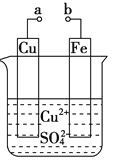
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,m为单质,d是淡黄色粉末,b是生活中常见的液态化合物。上述物质的转化关系如图所示。下列说法正确的是

A. 化合物a中只含有C、H两种元素
B. 几种元素的原子半径由大到小顺序为Z>Y>X>W
C. d是离子化合物,阴阳离子个数比为1:2
D. Y与W形成的简单化合物是同主族元素同类型化合物中沸点最低的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用中和反应反应热的测定方法,即保温、隔热条件下,向盛有20mL2.08mol/L的NaOH溶液的试管中分五次共加入5 mL未知浓度的H2SO4溶液(边加边振荡,每次加入1 mL)后,测得溶液的温度分别是21.4℃、22.5℃、24.2℃、25.2℃、25.18℃,则该硫酸溶液的物质的量浓度约是( )
A. 20.8 mol/L B. 5.2 mol/L C. 6.9 mol/L D. 4.16 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4LSO3含有NA个分子
B.1molNaHSO4溶于水后电离出的离子数目为2NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA
D.0.1mol·L-1的Ba(OH)2溶液中含有的OH-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的BaCl2溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是
A.①②③⑤④B.③②①⑤④C.②①③④⑤D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物和条件已略去),请回答下列问题:

(1)若A为CO2气体,D为NaOH溶液,则B的化学式为_________。
(2)若A为AlCl3溶液,D为NaOH溶液,则C的名称为_________。
(3)若A和D均为非金属单质,D为双原子分子,则由C直接生成A的基本反应类型为_________。
(4)若常温时A为气态氢化物,B为淡黄色固体单质,则A与C反应生成B的化学方程式为_________。
(5)若A为黄绿色气体,D为常见金属,则A与C溶液反应的离子方程式为_________。下列试剂不能鉴别B溶液与C溶液的是_________(填字母编号)。
a.NaOH溶液b.盐酸c.KSCN溶液d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和100℃时,其电离平衡曲线如图所示:
(1)100℃时,水的离子积KW =_______,0.01mol/L NaOH溶液的PH =_____,水的电离平衡曲线应为_____(填“A”或“B”)。

(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____
(3)25℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A. pH=a的氨水,稀释10倍后,其pH=b,则a=b+1
B. 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7
C. 向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
D. 向10mL pH=11的氨水中,加入10mL pH=3的H2SO4溶液,混合液pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com