
【题目】已知水在25℃和100℃时,其电离平衡曲线如图所示:
(1)100℃时,水的离子积KW =_______,0.01mol/L NaOH溶液的PH =_____,水的电离平衡曲线应为_____(填“A”或“B”)。

(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____
(3)25℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________。
【答案】1×10-12 10 B 10∶1 PH1+PH2=16 (或a+b=16)
【解析】
(1)因为水的电离是吸热过程,升温温度会促进水电离,以此确定100℃时水的离子积;
(2)先根据温度和混合溶液pH大小确定溶液的酸碱性,根据溶液的pH计算酸和碱的体积之比;
(3)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的PH1与强碱的PH2之间应满足的关系。
(1)100℃时,水的离子积KW =C(H+)×C(OH-)=10-6×10-6=1×10-12,0.01mol/L NaOH溶液C(H+)=10-12/0.01=10-10,所以PH =10,水的电离平衡曲线应为B;
正确答案:1×10-12;10;B。
(2)25℃时,所得混合溶液的pH=7说明溶液呈中性,酸碱恰好完全中和,pH=9的NaOH溶液中C(OH-)=10-5 mol/L, pH=4的H2SO4溶液中C(H+)=10-4 mol/L,则10-5×V(碱)= 10-4×V(酸)得出V(碱)/ V(酸)=10:1;
正确答案:10:1。
(3)25℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则10-a×100=10b-14×1,得a+b=16;
正确答案:PH1+PH2=16 (或a+b=16)。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )

A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)磷在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式_______。
(2)钛存在两种同素异形体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,由
采纳体心立方堆积,由![]() 转变为
转变为![]() 晶体体积______(填“膨胀”或“收缩”)
晶体体积______(填“膨胀”或“收缩”)
(3)[Cu(CH3CN)4]+是非常稳定的络合离子,配体中![]() 键和π键个数之比为_______。
键和π键个数之比为_______。
(4)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的Ka2_________苯酚(
,相同温度下,水杨酸的Ka2_________苯酚(![]() )的Ka(填“>”“ =”或“<”)
)的Ka(填“>”“ =”或“<”)
(5)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220![]() C。Cr(CO)6的晶体类型是_____,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的化学键类型为_______。
C。Cr(CO)6的晶体类型是_____,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的化学键类型为_______。
(6)已知N-N、N=N和N≡N键能之比为1.00:2.17:4.90.而C-C、C=C、C≡C键能之比为1.00:1.77:2.34.如何用这些数据理解氮分子不容易发生加成反应而乙炔容易发生加成反应?_____________。
(7)将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构——T-碳。已知T-碳密度为![]() g/cm,阿伏加德罗常数为NA,则T-碳的晶胞参数a=_______pm(写出表达式即可)
g/cm,阿伏加德罗常数为NA,则T-碳的晶胞参数a=_______pm(写出表达式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物分离和提纯常用下图装置进行,按要求回答下列问题:

(1)仪器①的名称__________。
(2)除去澄清石灰水中悬浮的CaCO3颗粒应选用_______(填字母,下同)。
(3)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物应选用_______。
(4)用CCl4提取碘水中的碘单质应选用_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是
A. 电解熔融NaCl制取金属钠的反应中,钠离子被还原,氯离子被氧化
B. 湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e
D. 铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期元素的一部分,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)
① | ② | ||||||||||||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||
⑨ | ⑩ | ||||||||||||||||
⑴上述元素中金属性最强和非金属性最强的元素名称分别是_____________;
(2) ⑥和⑦的气态氢化物稳定性比较(写化学式):_____________________;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为_________;其与④的最高价氧化物对应水化物反应的化学方程式为______________________________ 。
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是______________________________;
(5)比较⑦和⑨对应简单离子的离子半径大小(用相应离子符号表示)______________________________。
(6)写出⑨的最高价氧化物对应水化物的电子式____________________;其含有的化学键类型是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:
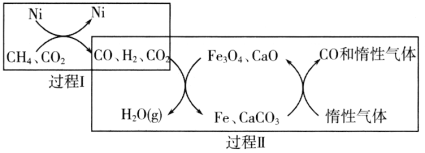
①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为________。
②关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中![]() ,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com