
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与H2O
B.BeCl2与BF3
C.CH4与NH3
D.C2H2与C2H4
【答案】C
【解析】解:A.CO2中C原子杂化轨道数为 ![]() ×(4+0)=2,采取sp杂化方式,H2O中O原子杂化轨道数为
×(4+0)=2,采取sp杂化方式,H2O中O原子杂化轨道数为 ![]() ×(6+2)=4,采取sp3杂化方式,两者中心原子杂化轨道的类型不同,故A错误;
×(6+2)=4,采取sp3杂化方式,两者中心原子杂化轨道的类型不同,故A错误;
B.BeCl2中Be原子杂化轨道数为 ![]() (2+2)=2,采取 sp杂化方式,BF3中B原子杂化轨道数为
(2+2)=2,采取 sp杂化方式,BF3中B原子杂化轨道数为 ![]() (3+3)=3,采取 sp2杂化方式,两者中心原子杂化轨道的类型不同,故B错误;
(3+3)=3,采取 sp2杂化方式,两者中心原子杂化轨道的类型不同,故B错误;
C.CH4中C原子杂化轨道数为 ![]() ×(4+4)=4,采取sp3杂化方式,NH3中N原子杂化轨道数为
×(4+4)=4,采取sp3杂化方式,NH3中N原子杂化轨道数为 ![]() (5+3)=4,采取 sp3杂化方式,两者中心原子杂化轨道的类型相同,故C正确;
(5+3)=4,采取 sp3杂化方式,两者中心原子杂化轨道的类型相同,故C正确;
D.C2H2分子中碳原子形成1个C﹣H,1个C≡C三键,C原子杂化轨道数为(1+1)=2,采取 sp杂化方式,C2H4分子中碳原子形成2个C﹣H,1个C═C双键,C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式,两者中心原子杂化轨道的类型不同,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示的装置对SO2气体的那分性质进行观察和探究。下对说法中的现象和结论均正确的是
选项 | 试剂 | 现象 | 结论 |
A | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
B | 品红溶液 | 溶液褪色 | SO2有还原性 |
C | 滴有酚酞的NaOH溶液 | 溶液褪色 | SO2有酸性 |
D | 紫色石蕊试液 | 溶液先变红后褪色 | SO2有酸性、有漂白性 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硝酸银溶液为滴定液,测定能与Ag+反应生成难溶性电解质的一种容量分析方法叫银量法。其原理如下:
①Ag++X-=AgX↓(X-表示Cl-、Br-、I-、CN-、SCN-等离子)——用于定量计算
②2Ag++CrO42-=Ag2CrO4↓(砖红色)——用于指示滴定的終点
[已知: Ksp(AgCl)=2.0×10-10,Ksp(Ag2CrO4)=1.12×10-12]。
某氯碱厂为测定饱和食盐水被电解后所得淡盐水(见图)里氯化钠的浓度,采用以上银量法,每次取20.00ml 淡盐水进行滴定,共进行了三次。据此,回答下列问题:

(1)配制100mL 0.4mol/L的硝酸银溶液(标准液)时,需要用托盘天平称取____gAgNO3固体,制成的溶液需置于棕色试剂瓶中(备用),原因是_______________。
(2)为了使溶液中的Cl-恰好沉淀完全(溶液中残余Cl-的浓度是1.0×10-5mol/L),溶液中(CrO42-)的浓度度应为______mol/L,若CrO42-的浓度大于此数值,则测定结果会偏_____(填“高”或“低”)。滴定时,若此时消耗AgNO3溶液25.00mL.( 三次实验的平均值),则淡盐水中氯化钠的浓度是______mol/L。
(3)根据相关离子的性质,滴定时溶液的pH值应控制在6.5~10,pH值太大或太小对实验均有不良影响,pH值太大的不良影响是__________(用离子反应方程式表示)。
(4)AgCl沉淀易吸附Cl-为减少AgC1沉淀对Cl-的吸附,从而减小实验的误差,实验时应采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
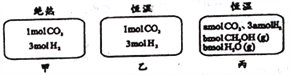
A. 刚开始反应时速率:甲>乙 B. 平衡后反应放热:甲>乙
C. 500℃下该反应平衡常数:K=3×102 D. 若a≠0,则0.9<b<l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com