
【题目】5.8g某有机物A完全燃烧只生成体积比为1:1(同压同温)的CO2和H2O蒸气,若把它们通过碱石灰,碱石灰增加18.6g;等质量的有机物A与0.1 mol乙酸完全发生酯化反应。已知该有机物A蒸气的密度是相同条件下空气密度的2倍,其核磁共振氢谱中有4个信号峰。回答下列问题:
(1)有机物A的相对分子质量________________________;
(2)有机物A的分子式是________________________;
(3)有机物A的结构简式是________________________;
(4)写出有机物A与乙酸反应的化学方程式________________________________。
【答案】 58 C3H6O CH2= CHCH2OH CH3COOH + CH2= CHCH2OH ![]() CH3COOCH2CH=CH2+H2O
CH3COOCH2CH=CH2+H2O
【解析】试题分析:该有机物对空气的相对密度为2,则有机物相对分子质量=29×2=58,5.8g某有机物的物质的量5.8g有机物的物质的量为![]() 0.1mol,燃烧生成CO2和H2O气且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,则n(CO2)=n(H2O)=
0.1mol,燃烧生成CO2和H2O气且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,则n(CO2)=n(H2O)=![]() 0.3mol,
0.3mol,
则有机物分子中N(C)=![]() 3;N(H)=6;、N(O)=
3;N(H)=6;、N(O)=![]()
故有机物分子式为C3H6O;核磁共振氢谱中有4个信号峰,A与0.1 mol乙酸完全发生酯化反应,说明含有羟基,结构简式为CH2= CHCH2OH。
解析:(1)有机物A的相对分子质量58;
(2)有机物A的分子式是C3H6O;
(3)有机物A的结构简式是CH2= CHCH2OH;
(4)CH2= CHCH2OH与乙酸反应的化学方程式是
CH3COOH + CH2= CHCH2OH ![]() CH3COOCH2CH=CH2+H2O
CH3COOCH2CH=CH2+H2O


科目:高中化学 来源: 题型:
【题目】Fe3+、SO42-、Mg2+ 和X四种离子以物质的量之比1∶2∶1∶1大量共存于同一溶液中,X可能是
A.NH4+ B.OH- C.CO32- D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分Fe2+在风化过程中会转化为+3价。

已知:TiO(OH)2(即H2TiO3)为两性氢氧化物
(1)步骤②中,发生反应的主要离子方程式为______________________。
(2)步骤③中,实现混合物的分离是利用物质的____________(填字母序号)。
A.熔沸点差异 B.溶解性差异 C.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是____________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:________________________________。
(5)上述工艺流程中可以循环利用的物质是____________。
(6)在酸性环境中,利用电化学原理可生成的羟基自由基(·OH) 其反应为Fe2++H2O2=Fe3++OH-+·OH-,成的羟基自由基对有机物有极强的氧化能力,可用于水体里有机污染物降解的高级氧化技术。电解原理如图:

①写出阳极所发生反应的电极反应式__________________________。
②电解过程中,假设电极上每1molFe3+转变为Fe2+ 的同时也 消耗1molO2,则 每消耗1molO2电解液中可以产生______mol ·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,室温下向盛有3.0mL NO的试管中缓缓通入1.5mL O2(所有气体体积均在标准状况下测定)。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①____________________________________________________________________;
②____________________________________________________________________;
③____________________________________________________________________。
(2)最终试管中剩余的气体是________,体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
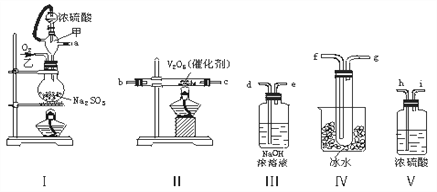
(1)装置的连接顺序(按气体左右的方向)是________________________________________________________(填各接口的编号)。
(2)实验时甲仪器的作用与原理是__________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序___________________________________________________。
(4)Ⅳ处观察到的现象是____________________________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会________(填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为_______________________。(用n、m表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种溶液中含有一种卤素离子(Cl-、Br-、I-),向甲中加入淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙中依次含有( )
A. Br-、I-、Cl-B. Br-、Cl-、I-C. I-、Br-、Cl-D. Cl-、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是评价空气质量的污染物之一,主要来源于硫酸工厂的尾气和含硫燃料的燃烧。
(1)硫酸厂尾气一般采用吸收法处理。
①已知Ka(H2SO3)=1.54x10-2,Ka(HSO3-)=1.02x10-7,Kb(NH3·H2O)=1.77x10-5,将标准状况下11.2L SO2通入到2L0.5mol·L-1的氨水中,所得溶液中溶质是__________(填化学式),该溶液呈______________(填“酸”“碱”或“中”)性。
②下列关于①所得的溶液的关系正确的是_____________(填序号)。
A.2[c(NH4+)+c(NH3·H2O)]=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
D.c(NH4+)+c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+)
③常温下,若用1LNaOH溶液吸收0.01mol SO2,完全吸收后溶液中c(Na+)= c(SO32-)+c(HSO3-)+ c(H2SO3),则原NaOH溶液的pH值为___________。
(2)燃煤烟气中可通过下列反应实现硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l)
2CO2(g)+S(l)
①该反应的平衡常数表达式是____________。
②恒温恒压下,5分钟时,反应到达平衡,气体密度减小16g·L-1,则0-5分钟内CO的反应速率是__________,若升高温度气体的密度增加,则该反应的△H__________0(填“>”或“<”)。
③下列措施,既能提高该反应的反应速率,又能提高SO2的吸收率的是__________(填序号)。
A. 加压 B.增加SO2的浓度
B. 升高温度 D.移走产物
(3)SO2还能被多种物质吸收。
①写出SO2与Ba(NO3)2溶液反应的离子方程式:_______________。
②如果用含等物质的量溶质的下列个溶液分别吸收SO2,则理论吸收量由多到少的顺序是__________(用序号排序)。
A. H2S B.Na2SO3
C.BaCl2 D.酸性KMnO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com