
����Ŀ��ʵ������ȡSO2�ķ�Ӧԭ��Ϊ��Na2SO3��H2SO4��Ũ��===Na2SO4��SO2����H2O����������װ�����һ��ʵ�飬�ԲⶨSO2ת��ΪSO3��ת���ʣ�
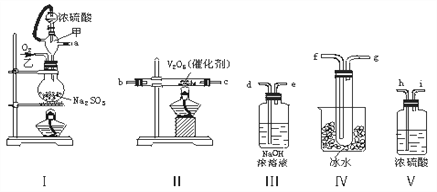
��1��װ�õ�����˳���������ҵķ�����________________________________________________________������ӿڵı�ţ���
��2��ʵ��ʱ��������������ԭ����__________________________________��
��3�����Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ��ʱ����Ũ��������ȴ������Ⱥ�˳��___________________________________________________��
��4�������۲쵽��������____________________________________________��
��5���ڢ��ô�������ƿʱ��SO2��ת���ʻ�________����������䡱��С������
��6����n mol Na2SO3��ĩ������Ũ������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ��Ƶâ�����m g����ʵ����SO2��ת����Ϊ_______________________������n��m��ʾ��
���𰸡� a h i b c f g d ������ʹŨ������˳���ص�����ƿ�У�ԭ����ά����ƿ��ѹǿ���Һ©����ѹǿ��� �ȼ���V2O5��������Ũ���� ����ɫ�����ɫ�����壨����壩���� ��С 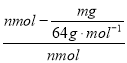 ��100%��
��100%��![]() ��100%
��100%
����������1��װ��I��ȡ��SO2��O2����������װ��II��������������õ�SO2��O2�����ɵ�SO3�Ļ�����壻Ϊ�ⶨSO2��SO3������SO3��װ��IV�о�����ˮ��������SO2��������װ��III�еļ�Һ���գ��ʽӿڵ�����˳��Ϊa h i b c f g d����2��ͨ��ά����ƿ��ѹǿ���Һ©����ѹǿ��ȣ�ʹ©���е�Һ����˳���ĵ�������3��SO2�Ĵ���������Ҫ�ڸ����½��еģ�Ϊ���SO2��ת���ʣ�Ӧ�ȼ���װ��II�еIJ����ܣ��ٵμ�Ũ��������4����ˮ���¶ȵ���SO3���۵㣬����IV���ɿ�������������SO3��������5����5���ڢ��ô�������ƿʱ��SO2��ת���ʻ��С����6��������m g���Dz���ת�����SO2�������������ʵ���Ϊ![]() mol����������SO2�������ʵ���Ϊn mol����ʵ����SO2��ת���ʣ�2SO2��O2
mol����������SO2�������ʵ���Ϊn mol����ʵ����SO2��ת���ʣ�2SO2��O2![]() 2SO3��Ϊ
2SO3��Ϊ![]() ��100%��
��100%��


 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ӧ�У�������Ӧ�뻹ԭ��Ӧ��ͬ��Ԫ���н��е���
A. Cl2+2NaOH��NaCl+NaClO+H2O B. 2KClO3![]() 2KCl+3O2��
2KCl+3O2��
C. 2KMnO4![]() K2MnO4+MnO2+O2�� D. 2H2O
K2MnO4+MnO2+O2�� D. 2H2O![]() 2H2��+O2��
2H2��+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֬�ް�סԼ0.2 g�������ƹ����ĩ������ʯ�����ϣ�Ȼ������й������Ƶ�λ�õμ�����ˮ�������֬����ȼ�ա�
��1������֬����ȼ�տɵó�����������ˮ��Ӧ�Ľ����ǣ�
a��_______________________________________
b��______________________________________
��2��д������������ˮ��Ӧ�����ӷ���ʽ��________________________________________
��3��ij�о���ѧϰС�飬������ͼ��ʾ��װ�ý���ʵ�飬��֤������2�����ۡ�ʵ��IJ��������������ǣ�____________________

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾװ���ռ�����8�����壨ͼ����ƿ��λ�ò��ñ仯����H2����Cl2����CH4����HCl����NH3����NO����H2S����SO2

��1������ƿ�Ǹ���ģ�����B�ڽ����ռ���������________��д��ţ���
��2������ƿ����ˮ�����ռ���������________����ʱ������________���롣
��3������ƿ�Ǹ���ģ�����A�ڽ��������ռ���������________��
��4��������ƿ��װ��Ũ����ʹ����������ô�װ���������������____����ʱ������________�ڽ��롣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5.8gij�л���A��ȫȼ��ֻ���������Ϊ1:1(ͬѹͬ��)��CO2��H2O��������������ͨ����ʯ�ң���ʯ������18.6g�����������л���A��0.1 mol������ȫ����������Ӧ����֪���л���A�������ܶ�����ͬ�����¿����ܶȵ�2������˴Ź�����������4���źŷ塣�ش��������⣺
��1���л���A����Է�������________________________��
��2���л���A�ķ���ʽ��________________________��
��3���л���A�Ľṹ��ʽ��________________________��
��4��д���л���A�����ᷴӦ�Ļ�ѧ����ʽ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�ã������������绯ѧʵ�顣�����йش�װ�õ������У���ȷ����

A. ��XΪͭ����YΪ����ͭ��Һ������K����N�����������������ӣ���Һ��ͭ����Ũ�Ƚ���С
B. ��XΪ̼����YΪNaCl��Һ������K����N�����ɼ������ĸ�ʴ����Һ�е������������缫�ƶ�
C. ��XΪ̼����YΪ����ͭ��Һ������K����M����̼�����������ӣ���ʱ���·�еĵ��������缫�ƶ�
D. ��XΪͭ����YΪNaCl��Һ������K����M�����ɼ������ĸ�ʴ�����ַ�����Ϊ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������﮵��װ����ͼ��ʾ�����������������ʯ��LiFePO4ͨ��ճ�ϼ��������������棬����ʯī���ϸ�����ͭ�����棬�����Ϊ�ܽ����л��ܼ��е���Ρ���ع���ʱ���ܷ�ӦΪ��LiFePO4+6C ![]() Li1-xFePO4+LixC6��������˵����ȷ����
Li1-xFePO4+LixC6��������˵����ȷ����

A. ͼ�оۺ����Ĥ�������ӽ���Ĥ��
B. ���ʱ��Li�� Ǩ�Ʒ����ǡ���������
C. �ŵ�ʱ�������ĵ缫��ӦʽΪLiFePO4��xe�� = Li1-xFePO4 + xLi��
D. �øõ�ص�⾫��ͭ����ת�Ƶ���1.25molʱ�ܵõ���ͭ32g,�����������Ϊ80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����10mLŨ�Ⱦ�Ϊ0.1mol/L��NaOH��CH3COONa�����Һ�еμ�0.1mol/L�����ᣬ���õζ�������ͼ��ʾ������˵����ȷ����
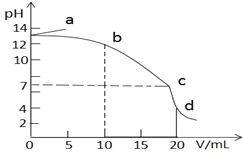
A. a����Һ��ˮϡ�ͣ�![]() ������
������
B. b��c�η�����Ӧ�����ӷ���ʽ�ǣ�CH3COO�� + H�� = CH3COOH
C. c��ʱˮ�ĵ���̶����
D. d����Һ��c��Na����=c��Cl����>c��CH3COOH��>c��CH3COO����>c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��е�������Ԫ��������3d���ӵ�Ӱ�죬���ʵĵݱ�����������Ԫ�����в�ͬ��
��1���������ڹ���Ԫ�ص������������γɶ��ֶ����������
�� CO���Ժͺܶ���ɽ����γ��������ʻ�����Fe(CO)5�ݣ��ʻ�����Ni(CO)4�ݡ�CO������Cԭ������һ�Թ¶Ե��ӣ�C��Oԭ�Ӷ�����8�����ȶ��ṹ��CO�ĽṹʽΪ ����CO��Ϊ�ȵ����������Ϊ (�ѧʽ)��
�� ����������CO�����������ȣ�����Һ̬Ni(CO)4���ӡ�423Kʱ��Ni(CO)4�ֽ�ΪNi��CO���Ӷ��Ƶøߴ��ȵ�Ni�ۡ����Ʋ�Ni(CO)4���������� ��
A��ˮ B�����Ȼ�̼ C���� D����������Һ
��2����������Ԫ�صĵ�һ��������ԭ��������������������������ġ��صĻ�̬ԭ�ӵĵ����Ų�ʽ�� ��Ga�ĵ�һ������ȴ���Ե���Zn��ԭ���� ��
��3���ü۲���ӶԻ�������Ԥ��H2Se��BBr3������ṹ���������۶���ȷ���� ��
A��ֱ���Σ�������
B��V��������
C��ֱ���Σ�ƽ��������
D��V�Σ�ƽ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com