
【题目】SO2是评价空气质量的污染物之一,主要来源于硫酸工厂的尾气和含硫燃料的燃烧。
(1)硫酸厂尾气一般采用吸收法处理。
①已知Ka(H2SO3)=1.54x10-2,Ka(HSO3-)=1.02x10-7,Kb(NH3·H2O)=1.77x10-5,将标准状况下11.2L SO2通入到2L0.5mol·L-1的氨水中,所得溶液中溶质是__________(填化学式),该溶液呈______________(填“酸”“碱”或“中”)性。
②下列关于①所得的溶液的关系正确的是_____________(填序号)。
A.2[c(NH4+)+c(NH3·H2O)]=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
D.c(NH4+)+c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+)
③常温下,若用1LNaOH溶液吸收0.01mol SO2,完全吸收后溶液中c(Na+)= c(SO32-)+c(HSO3-)+ c(H2SO3),则原NaOH溶液的pH值为___________。
(2)燃煤烟气中可通过下列反应实现硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l)
2CO2(g)+S(l)
①该反应的平衡常数表达式是____________。
②恒温恒压下,5分钟时,反应到达平衡,气体密度减小16g·L-1,则0-5分钟内CO的反应速率是__________,若升高温度气体的密度增加,则该反应的△H__________0(填“>”或“<”)。
③下列措施,既能提高该反应的反应速率,又能提高SO2的吸收率的是__________(填序号)。
A. 加压 B.增加SO2的浓度
B. 升高温度 D.移走产物
(3)SO2还能被多种物质吸收。
①写出SO2与Ba(NO3)2溶液反应的离子方程式:_______________。
②如果用含等物质的量溶质的下列个溶液分别吸收SO2,则理论吸收量由多到少的顺序是__________(用序号排序)。
A. H2S B.Na2SO3
C.BaCl2 D.酸性KMnO4
【答案】(1)①(NH4)2SO3;碱性;②C;③12
(2)①![]() ;②0.2mol/Lmin;<;③A
;②0.2mol/Lmin;<;③A
(3)①2NO3-+3Ba2++3SO2+2H2O=2NO+3BaSO4↓+4H+;②DBAC
【解析】
试题分析:(1)①标准状况下11.2L SO2的物质的量为0.5mol,含氨的物质的量为2L×0.5mol·L-1=1mol的氨水中,所得溶液中溶质是(NH4)2SO3;由于Ka(HSO3-)=1.02x10-7小于Kb(NH3·H2O)=1.77x10-5,所以该溶液呈碱性。故答案为:(NH4)2SO3;碱性;
②①所得的溶液的溶质为(NH4)2SO3。A.依据质量数:c(NH3)+c(NH4+)+c(NH3·H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],故A错误;B.依据电荷守恒:c(NH4+)+c(H+)= 2c(SO32-)+c(HSO3-)+c(OH-),故B错误;C.(NH4)2SO3溶液中离子浓度大小关系为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故C正确;D.依据质量守恒关系式,且溶液呈碱性,则c(NH4+)+ c(OH-)>c(HSO3-)+2c(H2SO3)+ c(H+),故D错误。故答案为:C;
③常温下,若用1LNaOH溶液吸收0.01molSO2,完全吸收后溶液中c(Na+)= c(SO32-)+c(HSO3-)+ c(H2SO3),说明n(NaOH)=n(SO2)=0.01mol,则原NaOH溶液的c(H+)=Kw/c(OH-)=10-12mol/L,pH值为12。故答案为:12;
(2)①燃煤烟气中可通过下列反应实现硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l),则该反应的平衡常数表达式是
2CO2(g)+S(l),则该反应的平衡常数表达式是![]() 。故答案为:
。故答案为:![]() ;
;
②已知恒温恒容下,S不是气体,且5分钟时,反应到达平衡,气体密度减小16g·L-1,则0-5分钟内CO的浓度变化量为:△c(CO)=2×16g·L-1÷32g/mol=1.0mol/L,v(CO)=1.0mol/L÷5min=0.2mol/L min;依据方程式可知,S不是气体,该反应的正反应是气体密度减小的反应,若升高温度气体的密度增加,则该反应的△H<0。故答案为:0.2mol/L min;< ;
③A.加压化学反应速率增大,平衡向正反应方向移动,SO2的吸收率提高,故A正确;B.增加SO2的浓度化学反应速率增大,平衡向正反应方向移动,但SO2的吸收率降低,故B错误;C.升高温度化学反应速率增大,平衡向逆反应方向移动,SO2的吸收率
(3)①SO2还能被Ba(NO3)2溶液吸收,SO2与Ba(NO3)2溶液反应的离子方程式:2NO3-+3Ba2++3SO2+2H2O = 2NO+3BaSO4 ↓+4H+。
②依据化学方程式可知,如果均用含1mol溶质的下列个溶液分别吸收SO2,则理论吸收量A.H2S吸收0.5mol;B.Na2SO3吸收1mol;C.BaCl2与SO2不反应,不能吸收SO2;D.酸性KMnO4吸收2.5mol。即由多到少的顺序是DBAC。故答案为:DBAC。


科目:高中化学 来源: 题型:
【题目】有机物A 的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是______(填字母代号)。
(2)写出由A生成B的化学方程式:________________。
(3)已知HCHO分子中所有原子在同一平面内,则上述分子中所有的原子有可能都在同一平面内的是______(填字母代号)。
(4)C能形成高聚物,该高聚物的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.8g某有机物A完全燃烧只生成体积比为1:1(同压同温)的CO2和H2O蒸气,若把它们通过碱石灰,碱石灰增加18.6g;等质量的有机物A与0.1 mol乙酸完全发生酯化反应。已知该有机物A蒸气的密度是相同条件下空气密度的2倍,其核磁共振氢谱中有4个信号峰。回答下列问题:
(1)有机物A的相对分子质量________________________;
(2)有机物A的分子式是________________________;
(3)有机物A的结构简式是________________________;
(4)写出有机物A与乙酸反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。电池工作时的总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,则下列说法正确的是
Li1-xFePO4+LixC6,则下列说法正确的是

A. 图中聚合物隔膜是阴离子交换膜;
B. 充电时,Li+ 迁移方向是“由右向左”
C. 放电时,正极的电极反应式为LiFePO4—xe- = Li1-xFePO4 + xLi+
D. 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提高合成洗涤剂的质量,一般要加入含磷的盐。大量使用含磷洗衣粉会对环境造成严重的危害,我国目前已限制含磷洗衣粉的生产和使用。含磷洗衣粉对环境造成的危害主要有( )
A. 造成大气中浮尘增多B. 造成农作物欠收
C. 引起酸雨D. 造成水体富营养化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在10mL浓度均为0.1mol/L的NaOH和CH3COONa混合溶液中滴加0.1mol/L的盐酸,所得滴定曲线如图所示。下列说法正确的是
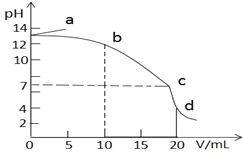
A. a点溶液加水稀释,![]() 逐渐增大
逐渐增大
B. b→c段发生反应的离子方程式是:CH3COO- + H+ = CH3COOH
C. c点时水的电离程度最大
D. d点溶液中c(Na+)=c(Cl-)>c(CH3COOH)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是
A. 原子半径:C>D>A>B
B. C和E的单质可通过电解饱和的CE水溶液获得
C. C与B形成的两种化合物中化学键类型完全相同
D. A、D、E的最高价氧化物对应水化物的酸性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中正确的是( )
A. 丙烷的2氯代物有3种同分异构体
B. C8H10中只有3种属于芳香烃的同分异构体
C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D. CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com