
【题目】已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是
A. 原子半径:C>D>A>B
B. C和E的单质可通过电解饱和的CE水溶液获得
C. C与B形成的两种化合物中化学键类型完全相同
D. A、D、E的最高价氧化物对应水化物的酸性逐渐增强
【答案】A
【解析】“组成有机物的必要元素”碳元素或氢元素;“最外层电子数是其电子层数的3倍”则B的核外电子排布为2 6,故B是氧元素;“化合物CE是厨房常用调味品”,则C是钠元素,E为氯元素;D的原子序数介于C、E之间,且D与A同主族,则D为硅元素,A为碳元素;则A、B、C、D、E 5种主族元素依次为:C、O、Na、Si、Cl;
A中四者在周期表中的位置关系为:
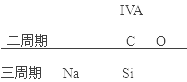
同周期,由左到右,原子半径逐渐减小,同主族,由上到下,原子半径逐渐增大,即原子半径:Na>Si>C>O,故A正确;
B、金属钠和氯气单质可通过电解熔融的氯化钠得到,而不是电解氯化钠溶液,故B错误;
C、Na2O中只有离子键、而Na2O2中既有离子键又有共价键,故C错误;
D中三种元素在周期表中的位置关系为:

同周期,由左到右,原子的得电子能力逐渐增强,则最高价氧化物对应水化物的酸性逐渐增强,同主族,由上到下,原子的得电子能力逐渐减弱,则最高价氧化物对应水化物的酸性逐渐减弱,故酸性:H2SiO3<H2CO3(弱酸)<HClO4(最强的含氧酸),D错误;


科目:高中化学 来源: 题型:
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分Fe2+在风化过程中会转化为+3价。

已知:TiO(OH)2(即H2TiO3)为两性氢氧化物
(1)步骤②中,发生反应的主要离子方程式为______________________。
(2)步骤③中,实现混合物的分离是利用物质的____________(填字母序号)。
A.熔沸点差异 B.溶解性差异 C.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是____________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:________________________________。
(5)上述工艺流程中可以循环利用的物质是____________。
(6)在酸性环境中,利用电化学原理可生成的羟基自由基(·OH) 其反应为Fe2++H2O2=Fe3++OH-+·OH-,成的羟基自由基对有机物有极强的氧化能力,可用于水体里有机污染物降解的高级氧化技术。电解原理如图:

①写出阳极所发生反应的电极反应式__________________________。
②电解过程中,假设电极上每1molFe3+转变为Fe2+ 的同时也 消耗1molO2,则 每消耗1molO2电解液中可以产生______mol ·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种溶液中含有一种卤素离子(Cl-、Br-、I-),向甲中加入淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙中依次含有( )
A. Br-、I-、Cl-B. Br-、Cl-、I-C. I-、Br-、Cl-D. Cl-、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是评价空气质量的污染物之一,主要来源于硫酸工厂的尾气和含硫燃料的燃烧。
(1)硫酸厂尾气一般采用吸收法处理。
①已知Ka(H2SO3)=1.54x10-2,Ka(HSO3-)=1.02x10-7,Kb(NH3·H2O)=1.77x10-5,将标准状况下11.2L SO2通入到2L0.5mol·L-1的氨水中,所得溶液中溶质是__________(填化学式),该溶液呈______________(填“酸”“碱”或“中”)性。
②下列关于①所得的溶液的关系正确的是_____________(填序号)。
A.2[c(NH4+)+c(NH3·H2O)]=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
D.c(NH4+)+c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+)
③常温下,若用1LNaOH溶液吸收0.01mol SO2,完全吸收后溶液中c(Na+)= c(SO32-)+c(HSO3-)+ c(H2SO3),则原NaOH溶液的pH值为___________。
(2)燃煤烟气中可通过下列反应实现硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l)
2CO2(g)+S(l)
①该反应的平衡常数表达式是____________。
②恒温恒压下,5分钟时,反应到达平衡,气体密度减小16g·L-1,则0-5分钟内CO的反应速率是__________,若升高温度气体的密度增加,则该反应的△H__________0(填“>”或“<”)。
③下列措施,既能提高该反应的反应速率,又能提高SO2的吸收率的是__________(填序号)。
A. 加压 B.增加SO2的浓度
B. 升高温度 D.移走产物
(3)SO2还能被多种物质吸收。
①写出SO2与Ba(NO3)2溶液反应的离子方程式:_______________。
②如果用含等物质的量溶质的下列个溶液分别吸收SO2,则理论吸收量由多到少的顺序是__________(用序号排序)。
A. H2S B.Na2SO3
C.BaCl2 D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷醇的结构简式如下图,下列说法正确的是

A. 薄荷醇分子中至少有12个碳原子共平面
B. 薄荷醇分子式为C10H20O,它是环戊醇的同系物
C. 1mol薄荷醇与足量Na反应生成22.4LH2
D. 在一定条件下,薄荷醇能发生取代、中和、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢吡格雷是一种血小板聚集抑制剂,该药物以2—氯苯甲醛为原料的合成路线如下

(1)A中含有的官能团名称为_________________________。其中1mol有机物A的含氧官能团含有的共用电子对数目为______NA。
(2)C→D的反应类型为_________________ ,有机反应物X的名称为______________。
(3)分子C在一定条件下生成一种含有3个六元环的产物的结构简式为_____________。
(4)写出Y在NaOH醇溶液加热条件下发生反应的化学反应方程式______________。
(5)同时满足下列两个条件的B的同分异构体共有_____种(不包括B,不考虑立体异构)
①与B含有相同的官能团;②苯环上的取代基不超过2个。
(6)已知:![]() ,则仅以甲醇、乙醇为有机原料制备
,则仅以甲醇、乙醇为有机原料制备
![]() 的合成路线流程图为______________________________________。
的合成路线流程图为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同温度和压强下,等质量的SO2和O2。二者体积比为________,分子个数比为________,密度比为________。
(2)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com