
【题目】下列物质都能使品红溶液褪色,但原理与其他物质不同的是( )
A. SO2 B. Na2O2 C. HClO D. 漂白粉
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是
A. 原子半径:C>D>A>B
B. C和E的单质可通过电解饱和的CE水溶液获得
C. C与B形成的两种化合物中化学键类型完全相同
D. A、D、E的最高价氧化物对应水化物的酸性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 溴乙烷在不同溶剂中与 NaOH 发生不同类型的反应,生成不同的反应产物。某 同学依据溴乙烷的性质,用右图实验装置 (铁架台、酒精灯略) 验证取代反应和消去 反应的产物,请你一起参与探究。

实验操作Ⅰ:在试管中加入 5mL1mol/LNaOH 溶液和 5mL 溴乙烷,振荡。 实验操作 II:将试管如图固定后,水浴加热。
(1) 用水浴加热而不直接用酒精灯加热的原因是 。
(2) 观察到 现象时,表明溴乙烷与 NaOH 溶液已完全 反应。
(3) 鉴定生成物中乙醇的结构,可用的波谱是 。
(4) 为证明溴乙烷在 NaOH 乙醇溶液中发生的是消去反应,在你设计的实验方案中, 需要检验的是 ,检验的方法是 。
(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中正确的是( )
A. 丙烷的2氯代物有3种同分异构体
B. C8H10中只有3种属于芳香烃的同分异构体
C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D. CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化关系中(未配平,条件略去),不正确的是( )
①N2+O2→NO2 ②Cl2+Fe→FeCl2 ③NO2+H2O→HNO3 ④SO3+Ca(OH)2→CaSO4+H2O.
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. 只有②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD, BAD的结构简式为:

BAD的合成路线如下(己知G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程是引入羧基的反应):
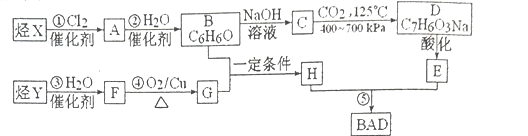
试回答下列问题:
(1)写出Y的结构简式________________;E的含氧官能团名称_______________。
(2)属于加成反应的有__________________(填数字序号)。
(3)1 mol BAD最多可与含________________mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④:______________________________;
F+E→:______________________________;
(5)E有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式 _________________。
A.能发生银镜反应 B.遇FeCl3溶液显紫色 C.核磁共振氢谱图中有4个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
(1)N、O、Na原子第一电离能由小到大的顺序是 (用元素符号和“<”表示);Cu原子的特征电子轨道式为 。
(2)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是_____;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为 ,水分子与铜离子间结合的化学键名称为 。
(3)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是_____(填序号):①H3O+、②H2O、 ③NO2+ 、④NO2- 。
(4)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 ,1个分子中含有____个![]() 键;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为 。
键;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为 。
(5)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为___________;已知该晶胞的密度为![]() ,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用含
,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用含![]() 、NA的代数式表示)。
、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com