
| A.X+ | B.X2+ | C.X3+ | D.X4+ |
 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:不详 题型:填空题
 质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
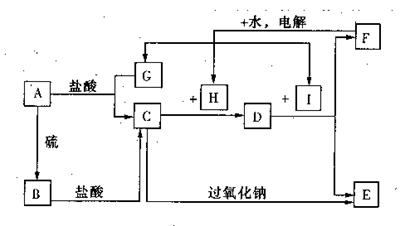
 采取的方法是 。
采取的方法是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
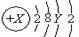 。则X、Y及该原子3p能级上的电子数分别为( )
。则X、Y及该原子3p能级上的电子数分别为( )| A.18、6、4 | B.20、8、6 | C.18、8、6 | D.15~20、3~8、1~6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
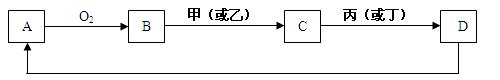
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
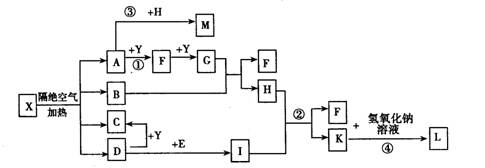
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com