
【题目】根据下图,下列判断中正确的是

A.石墨与O2生成CO2的反应是吸热反应
B.等量金刚石和石墨完全燃烧,金刚石放出热量更多
C.从能量角度看,金刚石比石墨更稳定
D.C(金刚石,s) = C(石墨,s) + Q kJ Q= E3—E2
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
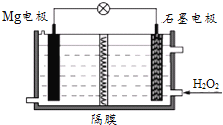
A.Mg电极是该电池的正极
B.溶液中的Cl-向正极移动
C.H2O2在石墨电极上发生氧化反应
D.石墨电极附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,萘可被浓硝酸和浓硫酸的混合液硝化生成二硝基化合物,它是1,5二硝基萘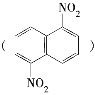 和1,8二硝基萘
和1,8二硝基萘 的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能,利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到1,8二硝基萘,应采用的方法是 ( )
的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能,利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到1,8二硝基萘,应采用的方法是 ( )
A.蒸发浓缩结晶B.向滤液中加水后过滤
C.用Na2CO3溶液处理滤液D.将滤液缓缓加入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳碳双键在酸性高锰酸钾溶液中发生断键氧化过程:![]()
![]()
![]() +
+![]()
完成下列填空:
(1)月桂烯是一种常见香料,其结构如图所示![]() 。
。
①月桂烯与等物质的量的Br2发生加成反应,可以得到______种产物。
②月桂烯与酸性高锰酸钾溶液反应时可生成多种有机产物,其中碳原子数最多的一种产物的结构简式为______。
③金刚烷(见图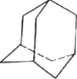 )是月桂烯的一种同分异构体,其一氯代物有______种。
)是月桂烯的一种同分异构体,其一氯代物有______种。
(2)烃X在酸性高锰酸钾溶液中生成等物质的量的丙酮(CH3COCH3)与羧酸Y(C5H10O2),且Y中仅含两种不同化学环境的氢原子,则Y的结构简式是______,X的系统命名为______。
(3)化学式为C8H12的烃Z,在酸性高锰酸钾溶液中生成CH3COCH2COOH,写出Z可能的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验;下列预期实验现象及相应结论均正确的是( )
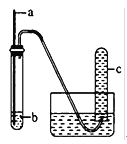
a | b | 预期实验现象 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )
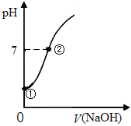
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCl2和NaHCO3按物质的量之比为1:2混合制成溶液,加热蒸干灼烧后得到的固体是( )
A.Mg(HCO3)2、NaClB.MgO、NaClC.MgCl2、Na2CO3D.MgCO3、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,反应①:I2(aq)+I-(aq)![]() I3-(aq) △H1;反应②: I3-(aq)
I3-(aq) △H1;反应②: I3-(aq) ![]() I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K1 | 1100 | 841 | 680 | 533 | 409 |
请回答:
(1)若反应②的化学平衡常数为K2,在相同温度下,K1·K2=____________。
(2)上述反应①的△H1_______0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会______(填“加快”、“减慢”或“不变”)。
(3)能判断反应①已达到平衡的依据是_______________
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800。在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(I2) | 0.1 | 0.2 | 0.2 |
c(I-) | 0.2 | 0.1 | 0.2 |
反应速率最快的是_____________(填“甲”、“乙”或“丙”),平衡时I2的转化率最大的是__________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com